ΚΑΤΑΣΤΟΛΗ ΤΟΥ ΕΜΦΥΤΟΥ ΑΝΟΣΟΠΟΙΗΤΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΑΠΟ ΕΜΒΟΛΙΑΣΜΟΥΣ ΜΕ MRNA SARS-COV-2: Ο ΡΟΛΟΣ ΤΩΝ G-QUADRUPLEXES, ΤΩΝ ΕΞΩΣΩΜΑΤΩΝ ΚΑΙ ΤΩΝ MICRORNAS
Τα κυριότερα σημεία
Τα εμβόλια mRNA προάγουν τη διαρκή σύνθεση της πρωτεΐνης SARS-CoV-2 spike.
Η πρωτεΐνη spike είναι νευροτοξική και επηρεάζει τους μηχανισμούς επιδιόρθωσης του DNA.
Η καταστολή των αποκρίσεων ιντερφερόνης τύπου Ι έχει ως αποτέλεσμα την εξασθένιση της έμφυτης ανοσίας.
Τα εμβόλια mRNA προκαλούν ενδεχομένως αυξημένο κίνδυνο για μολυσματικές ασθένειες και καρκίνο.
Η βελτιστοποίηση των κωδικονίων οδηγεί σε mRNA πλούσιο σε G που έχει απρόβλεπτες σύνθετες επιδράσεις.
Τα εμβόλια mRNA SARS-CoV-2 κυκλοφόρησαν στην αγορά ως απάντηση στις κρίσεις δημόσιας υγείας της Covid-19. Η χρήση εμβολίων mRNA στο πλαίσιο μολυσματικών ασθενειών δεν έχει προηγούμενο. Οι πολλές μεταβολές στο mRNA του εμβολίου κρύβουν το mRNA από τις κυτταρικές άμυνες και προάγουν μεγαλύτερο βιολογικό χρόνο ημιζωής και υψηλή παραγωγή πρωτεΐνης ακίδας.
Ωστόσο, η ανοσολογική απόκριση στο εμβόλιο είναι πολύ διαφορετική από εκείνη σε μια λοίμωξη SARS-CoV-2. Στην παρούσα εργασία παρουσιάζουμε στοιχεία που αποδεικνύουν ότι ο εμβολιασμός προκαλεί βαθιά εξασθένιση της σηματοδότησης της ιντερφερόνης τύπου Ι, η οποία έχει ποικίλες δυσμενείς συνέπειες για την ανθρώπινη υγεία.
Τα ανοσοκύτταρα που έχουν προσλάβει τα νανοσωματίδια του εμβολίου απελευθερώνουν στην κυκλοφορία μεγάλο αριθμό εξωσωμάτων που περιέχουν πρωτεΐνη spike μαζί με κρίσιμα microRNAs που επάγουν μια σηματοδοτική απόκριση σε κύτταρα-δέκτες σε απομακρυσμένες περιοχές.
Εντοπίζουμε επίσης πιθανές βαθιές διαταραχές στον ρυθμιστικό έλεγχο της πρωτεϊνοσύνθεσης και στην επιτήρηση του καρκίνου. Αυτές οι διαταραχές έχουν δυνητικά αιτιώδη σχέση με νευροεκφυλιστικές νόσους, μυοκαρδίτιδα, ανοσολογική θρομβοπενία, παράλυση Bell, ηπατική νόσο, διαταραγμένη προσαρμοστική ανοσία, διαταραγμένη απόκριση σε βλάβη του DNA και καρκινογένεση.
Παρουσιάζουμε στοιχεία από τη βάση δεδομένων VAERS που υποστηρίζουν την υπόθεσή μας. Πιστεύουμε ότι μια ολοκληρωμένη αξιολόγηση κινδύνου/οφέλους των εμβολίων mRNA τα αμφισβητεί ως θετικά συμβάλλοντα στη δημόσια υγεία.
1. Εισαγωγή
Ο εμβολιασμός είναι μια προσπάθεια χρησιμοποίησης μη παθογόνου υλικού για τη μίμηση της ανοσολογικής απόκρισης μιας φυσικής λοίμωξης, παρέχοντας έτσι ανοσία σε περίπτωση έκθεσης σε παθογόνο. Ο στόχος αυτός επιδιώκεται κυρίως με τη χρήση εμβολίων τόσο ολόκληρου του οργανισμού όσο και εξασθενημένων ιών.
Η χρήση τμημάτων του ιού ή των πρωτεϊνικών προϊόντων τους, που αναφέρονται ως “εμβόλια υπομονάδων”, έχει αποτελέσει μια μεγαλύτερη τεχνική πρόκληση (Bhurani et al., 2018).
Σε κάθε περίπτωση, μια αυτονόητη υπόθεση πίσω από την ανάπτυξη οποιασδήποτε εκστρατείας εμβολιασμού είναι ότι το εμβόλιο προσδίδει τα αποτελέσματα μιας “καλοήθους λοίμωξης”, ενεργοποιώντας το ανοσοποιητικό σύστημα έναντι μελλοντικής έκθεσης, αποφεύγοντας παράλληλα τις επιπτώσεις της πραγματικής λοίμωξης στην υγεία.
Μεγάλο μέρος της σχετικής βιβλιογραφίας που σχετίζεται με COVID-19 υποδηλώνει ότι η ανοσολογική απόκριση στον εμβολιασμό με βάση το mRNA είναι παρόμοια με τη φυσική λοίμωξη. Μια προτυπωμένη μελέτη διαπίστωσε “υψηλή ανοσογονικότητα του εμβολίου BNT162b2 σε σύγκριση με τη φυσική μόλυνση”.
Οι συγγραφείς διαπίστωσαν ότι υπάρχουν πολλές ποιοτικές ομοιότητες αν και ποσοτικές διαφορές (Psichogiou et al., 2021a). Ο Jhaveri (2021) προτείνει ότι τα εμβόλια mRNA κάνουν ό,τι και η μόλυνση με τον ιό: “Η πρωτεΐνη παράγεται και παρουσιάζεται με τον ίδιο τρόπο όπως και η φυσική μόλυνση”.
Το Κέντρο Ελέγχου και Πρόληψης Νοσημάτων των ΗΠΑ (CDC) προβάλλει την υπόθεση με βάση τους τίτλους αντισωμάτων που παράγονται από προηγούμενη μόλυνση έναντι του εμβολιασμού, εκτός από την παραγωγή κυττάρων μνήμης Β, για να υποστηρίξει ότι η ανοσολογική απόκριση στον εμβολιασμό είναι ανάλογη με την απόκριση στη φυσική μόλυνση (Centers for Disease Control and Prevention, 2021a).
Αυτή η ομοιότητα της χυμικής ανοσολογικής απόκρισης στον εμβολιασμό έναντι της φυσικής λοίμωξης, σε συνδυασμό τόσο με δεδομένα δοκιμών όσο και με δεδομένα παρατήρησης που καταδεικνύουν μειωμένο κίνδυνο λοίμωξης μετά τον εμβολιασμό, αποτελεί την αιτιολόγηση της εκστρατείας μαζικού εμβολιασμού.
Η εργασία μας συνοψίζει την τρέχουσα βιβλιογραφία σχετικά με το mRNA και τις επιδράσεις του στη μοριακή βιολογία εντός των ανθρώπινων κυττάρων.
Αναγνωρίζουμε ότι υπάρχει ένα ευρύ φάσμα απόψεων σε αυτή την εκκολαπτόμενη φάση της τεχνολογίας mRNA. Δεδομένης της ευρείας ανάπτυξής της πριν από τη βασική εργασία σε τόσους πολλούς από τους μηχανισμούς που συζητάμε εδώ, πιστεύουμε ότι η εργασία μας είναι σημαντική για την παροχή μιας ευρείας κατανόησης των σημερινών και μελλοντικών αναθεωρήσεων που αφορούν την εκρηκτική προκλινική μοριακή εργασία που γίνεται σε αυτόν τον τομέα.
Στην παρούσα εργασία, διερευνούμε την επιστημονική βιβλιογραφία που υποδηλώνει ότι ο εμβολιασμός με ένα εμβόλιο mRNA εκκινεί ένα σύνολο βιολογικών γεγονότων που όχι μόνο διαφέρουν από εκείνα που προκαλούνται από τη μόλυνση, αλλά είναι με διάφορους τρόπους αποδεδειγμένα αντιπαραγωγικά τόσο για τη βραχυπρόθεσμη όσο και για τη μακροπρόθεσμη ανοσολογική επάρκεια και τη φυσιολογική κυτταρική λειτουργία.
Αυτοί οι εμβολιασμοί έχουν πλέον αποδειχθεί ότι ρυθμίζουν προς τα κάτω κρίσιμα μονοπάτια που σχετίζονται με την επιτήρηση του καρκίνου, τον έλεγχο των λοιμώξεων και την κυτταρική ομοιόσταση. Εισάγουν στο σώμα ιδιαίτερα τροποποιημένο γενετικό υλικό.
Μια προδημοσίευση αποκάλυψε μια αξιοσημείωτη διαφορά μεταξύ των χαρακτηριστικών της ανοσολογικής απόκρισης σε μια μόλυνση με SARS-CoV-2 σε σύγκριση με την ανοσολογική απόκριση σε ένα εμβόλιο mRNA κατά της COVID-19 (Ivanova et al., 2021).
Η διαφορική ανάλυση γονιδιακής έκφρασης των περιφερικών δενδριτικών κυττάρων αποκάλυψε μια δραματική ρύθμιση τόσο των ιντερφερόνων τύπου Ι όσο και των ιντερφερόνων τύπου ΙΙ (IFN) στους ασθενείς με COVID-19, αλλά όχι στους εμβολιασθέντες.
Μια αξιοσημείωτη παρατήρηση που έκαναν ήταν ότι υπήρχε επέκταση των κυκλοφορούντων αιμοποιητικών βλαστικών και προγονικών κυττάρων (HSPCs) στους ασθενείς με COVID-19, αλλά η επέκταση αυτή απουσίαζε αξιοσημείωτα μετά τον εμβολιασμό.
Μια εντυπωσιακή επέκταση των κυκλοφορούντων πλασματοβλαστών που παρατηρήθηκε στους ασθενείς με COVID-19 δεν παρατηρήθηκε επίσης στους εμβολιαζόμενους. Όλες αυτές οι παρατηρήσεις συνάδουν με την ιδέα ότι τα αντι-COVID-19 εμβόλια καταστέλλουν ενεργά τη σηματοδότηση της IFN τύπου Ι, όπως θα συζητήσουμε παρακάτω. Στην παρούσα εργασία θα επικεντρωθούμε εκτενώς, αν και όχι αποκλειστικά, στην επαγόμενη από τον εμβολιασμό καταστολή της IFN τύπου Ι και στις μυριάδες επακόλουθες επιδράσεις που έχει αυτό στον σχετικό καταρράκτη σηματοδότησης.
Δεδομένου ότι οι μακροχρόνιες προκλινικές δοκιμές και οι δοκιμές Φάσης Ι για την ασφάλεια συνδυάστηκαν με τις δοκιμές Φάσης ΙΙ, στη συνέχεια συνδυάστηκαν οι δοκιμές Φάσης ΙΙ και ΙΙΙ (Kwok, 2021)- και δεδομένου ότι ακόμη και αυτές τερματίστηκαν πρόωρα και δόθηκαν οι ενέσεις στα σκέλη του εικονικού φαρμάκου, αναζητάμε το σύστημα φαρμακοεπιτήρησης και τις δημοσιευμένες εκθέσεις για σήματα ασφαλείας. Με τον τρόπο αυτό, διαπιστώνουμε ότι τα εν λόγω στοιχεία δεν είναι ενθαρρυντικά.
Η βιολογική απόκριση στον εμβολιασμό με mRNA, όπως χρησιμοποιείται σήμερα, δεν είναι αποδεδειγμένα παρόμοια με τη φυσική λοίμωξη. Σε αυτή την εργασία θα παρουσιάσουμε αυτές τις διαφορές και θα περιγράψουμε τις ανοσολογικές και παθολογικές διαδικασίες που αναμένουμε ότι δρομολογούνται από τον εμβολιασμό με mRNA.
Θα συνδέσουμε αυτές τις υποκείμενες φυσιολογικές επιδράσεις τόσο με τις πραγματικές όσο και με τις νοσηρότητες που δεν έχουν ακόμη παρατηρηθεί. Αναμένουμε ότι η εφαρμογή των αναμνηστικών εμβολιασμών σε ευρεία κλίμακα θα ενισχύσει όλα αυτά τα προβλήματα.
Τα εμβόλια mRNA που κατασκευάζονται από την Pfizer/BioNTech και τη Moderna έχουν θεωρηθεί ως μια ουσιαστική πτυχή των προσπαθειών μας για τον έλεγχο της εξάπλωσης της COVID-19. Χώρες σε όλο τον κόσμο προωθούν επιθετικά προγράμματα μαζικού εμβολιασμού με την ελπίδα ότι οι προσπάθειες αυτές θα μπορούσαν τελικά να περιορίσουν τη συνεχιζόμενη πανδημία και να αποκαταστήσουν την ομαλότητα.
Οι κυβερνήσεις διστάζουν να αναλογιστούν το ενδεχόμενο ότι οι ενέσεις αυτές μπορεί να προκαλέσουν βλάβη με απροσδόκητους τρόπους, και ιδίως ότι η βλάβη αυτή μπορεί να ξεπεράσει ακόμη και τα οφέλη που επιτυγχάνονται στην προστασία από σοβαρές ασθένειες.
Είναι πλέον σαφές ότι τα αντισώματα που προκαλούνται από τα εμβόλια εξασθενούν σε μόλις 3-10 εβδομάδες μετά τη δεύτερη δόση (Shrotri et al., 2021), με αποτέλεσμα να συνιστάται στους ανθρώπους να ζητούν αναμνηστικά εμβόλια σε τακτά χρονικά διαστήματα (Centers for Disease Control and Prevention, 2021b).
Έχει επίσης καταστεί εμφανές ότι οι ταχέως αναδυόμενες παραλλαγές, όπως το στέλεχος Delta και τώρα το Omicron, παρουσιάζουν αντίσταση στα αντισώματα που προκαλούνται από τα εμβόλια, μέσω μεταλλάξεων στην πρωτεΐνη spike (Yahi et al., 2021). Επιπλέον, έχει καταστεί σαφές ότι τα εμβόλια δεν εμποδίζουν τη μετάδοση της νόσου, αλλά μπορεί να υποστηριχθεί ότι μειώνουν μόνο τη σοβαρότητα των συμπτωμάτων (Kampf, 2021a).
Μια μελέτη που συνέκρινε τα ποσοστά εμβολιασμού με τα ποσοστά μόλυνσης από COVID-19 σε 68 χώρες και 2947 κομητείες στις Ηνωμένες Πολιτείες στις αρχές Σεπτεμβρίου 2021, δεν διαπίστωσε καμία συσχέτιση μεταξύ των δύο, γεγονός που υποδηλώνει ότι τα εμβόλια αυτά δεν προστατεύουν από την εξάπλωση της νόσου (Subramanian and Kumar, 2947).
Όσον αφορά τη σοβαρότητα των συμπτωμάτων, ακόμη και αυτή η πτυχή έχει αρχίσει να αμφισβητείται, όπως έδειξε μια επιδημία σε ένα ισραηλινό νοσοκομείο που οδήγησε στο θάνατο πέντε πλήρως εμβολιασμένων ασθενών του νοσοκομείου (Shitrit et al., 2021). Ομοίως, οι Brosh-Nissimov και συν. (2021) ανέφεραν ότι 34/152 (22%) πλήρως εμβολιασμένων ασθενών μεταξύ 17 ισραηλινών νοσοκομείων πέθαναν από COVID-19.
Οι αυξανόμενες ενδείξεις ότι τα εμβόλια δεν συμβάλλουν σε μεγάλο βαθμό στον έλεγχο της εξάπλωσης της νόσου και ότι η αποτελεσματικότητά τους φθίνει με την πάροδο του χρόνου καθιστούν ακόμη πιο επιτακτική την ανάγκη να αξιολογηθεί ο βαθμός στον οποίο τα εμβόλια ενδέχεται να προκαλέσουν βλάβη.
Το ότι οι εμβολιασμοί με τροποποιημένη πρωτεΐνη spike mRNA SARS-CoV-2 έχουν βιολογικές επιπτώσεις είναι αναμφισβήτητο. Εδώ επιχειρούμε να διακρίνουμε αυτές τις επιπτώσεις από τη φυσική λοίμωξη και να δημιουργήσουμε ένα μηχανιστικό πλαίσιο που συνδέει αυτές τις μοναδικές βιολογικές επιπτώσεις με τις παθολογίες που συνδέονται τώρα με τον εμβολιασμό.
Αναγνωρίζουμε ότι οι αιτιώδεις συνδέσεις μεταξύ των βιολογικών επιδράσεων που ξεκινούν από τον εμβολιασμό με mRNA και των δυσμενών αποτελεσμάτων δεν έχουν τεκμηριωθεί στη μεγάλη πλειονότητα των περιπτώσεων.
2. Ιντερφερόνες: μια επισκόπηση με έμφαση στην πρόληψη του καρκίνου
Ανακαλύφθηκε το 1957, η ιντερφερόνη (IFN) κέρδισε το όνομά της με την παραδοχή ότι τα κύτταρα που προσβλήθηκαν από εξασθενημένο ιό της γρίπης Α δημιούργησαν μια ουσία που “παρεμποδίζει” μια επακόλουθη μόλυνση από ζωντανό ιό (Lindenmann, 1982).
Η IFN είναι πλέον κατανοητό ότι αντιπροσωπεύει μια πολύ μεγάλη οικογένεια πρωτεϊνών που ρυθμίζουν το ανοσοποιητικό σύστημα και χωρίζονται σε τρεις τύπους, που χαρακτηρίζονται ως τύπου Ι, ΙΙ και ΙΙΙ με βάση τους υποδοχείς με τους οποίους αλληλεπιδρά κάθε IFN. Η IFN τύπου Ι περιλαμβάνει τόσο την IFN-α όσο και την IFN-β, και ο τύπος αυτός είναι ο πιο ποικιλόμορφος, καθώς διαιρείται περαιτέρω σε δεκαεπτά υπότυπους.
Μόνο η IFN-α έχει δεκατρείς υπότυπους που έχουν αναγνωριστεί επί του παρόντος, και καθένας από αυτούς χωρίζεται περαιτέρω σε πολλαπλές κατηγορίες (Wang et al., 2017a). Οι IFN τύπου Ι διαδραματίζουν ισχυρό ρόλο στην ανοσολογική απόκριση σε πολλαπλούς στρεσογόνους παράγοντες.
Στην πραγματικότητα, έχουν αποκτήσει κλινική θεραπευτική αξία ως θεραπευτική επιλογή για μια ποικιλία ασθενειών και καταστάσεων, συμπεριλαμβανομένων των ιογενών λοιμώξεων, των συμπαγών όγκων, των μυελοϋπερπλαστικών διαταραχών, των αιμοποιητικών νεοπλασιών και των αυτοάνοσων ασθενειών όπως η σκλήρυνση κατά πλάκας (Passegu and Ernst, 2009).
Ως ομάδα, οι IFN διαδραματίζουν εξαιρετικά περίπλοκους και πλειοτροπικούς ρόλους που συντονίζονται και ρυθμίζονται μέσω της δραστηριότητας της οικογένειας των ρυθμιστικών παραγόντων IFN ή IRF (Kaur and Fang, 2020). Ο IRF9 εμπλέκεται πιο άμεσα στην αντι-ιική καθώς και στην αντι-καρκινική ανοσία και στη γενετική ρύθμιση (Alsamman and El-Masry, 2018– Huang et al., 2019– Zitvogel et al., 2015).
Στενά συνδεδεμένα με αυτό είναι τα πλασματοκυτταροειδή δενδριτικά κύτταρα (pDCs), ένας σπάνιος τύπος ανοσοποιητικών κυττάρων που κυκλοφορούν στο αίμα αλλά μεταναστεύουν στα περιφερικά λεμφοειδή όργανα κατά τη διάρκεια μιας ιογενούς λοίμωξης. Ανταποκρίνονται σε μια ιογενή λοίμωξη με απότομη ρύθμιση της παραγωγής των IFN τύπου Ι. Η IFN-α που απελευθερώνεται στους λεμφαδένες επάγει τα Β κύτταρα να διαφοροποιηθούν σε πλασματοβλάστες. Στη συνέχεια, η ιντερλευκίνη-6 (Il-6) επάγει τους πλασματοβλάστες να εξελιχθούν σε πλασματοκύτταρα που εκκρίνουν αντισώματα (Jego et al., 2003).
Έτσι, οι IFN διαδραματίζουν κρίσιμο ρόλο τόσο στον έλεγχο του ιικού πολλαπλασιασμού όσο και στην επαγωγή της παραγωγής αντισωμάτων. Κεντρικό ρόλο τόσο στην αντι-ιική όσο και στην αντικαρκινική ανοσία, η IFN-α παράγεται από τα μακροφάγα και τα λεμφοκύτταρα, όταν κάποιο από αυτά προσβληθεί από ιογενή ή βακτηριακή λοίμωξη ή συναντήσει καρκινικά κύτταρα (De Andrea et al., 2002).
Ο ρόλος της ως ισχυρής αντιικής θεραπείας έχει αναγνωριστεί στη θεραπεία επιπλοκών του ιού της ηπατίτιδας C (Feng et al., 2012), της λοίμωξης από τον κυτταρομεγαλοϊό (Delannoy et al., 1999), της χρόνιας ενεργού λοίμωξης από τον ιό ebola (Sakai et al., 1998), της φλεγμονώδους νόσου του εντέρου που σχετίζεται με λοίμωξη από τον ιό του έρπητα (Ruther et al., 1998) και άλλων.
Η εξασθενημένη σηματοδότηση της IFN τύπου Ι συνδέεται με πολλούς κινδύνους ασθενειών, κυρίως με τον καρκίνο, καθώς η σηματοδότηση της IFN τύπου Ι καταστέλλει τον πολλαπλασιασμό τόσο των ιών όσο και των καρκινικών κυττάρων, σταματώντας τον κυτταρικό κύκλο, εν μέρει μέσω της ρύθμισης του p53, ενός ογκοκατασταλτικού γονιδίου, και διαφόρων αναστολέων της κυκλινοεξαρτώμενης κινάσης (Musella et al., 2017– Matsuoka et al., 1998). Η IFN-α επάγει επίσης την παρουσίαση αντιγόνων μείζονος ιστοσυμβατότητας (MHC) τάξης 1 από τα καρκινικά κύτταρα, με αποτέλεσμα αυτά να αναγνωρίζονται ευκολότερα από το σύστημα επιτήρησης του καρκίνου (Heise et al., 2016– Sundstedt et al., 2008). Το εύρος των αντικαρκινικών επιδράσεων που εκκινεί η έκφραση της IFN-α είναι εκπληκτικό και λαμβάνει χώρα τόσο μέσω άμεσων όσο και έμμεσων μηχανισμών.
Οι άμεσες επιδράσεις περιλαμβάνουν τη διακοπή του κυτταρικού κύκλου, την επαγωγή της κυτταρικής διαφοροποίησης, την έναρξη της απόπτωσης, την ενεργοποίηση των κυττάρων φυσικών φονέων και των CD8+ T και άλλες (Schneider et al., 2014).
Οι έμμεσες αντικαρκινικές επιδράσεις πραγματοποιούνται κυρίως μέσω της ενεργοποίησης της γονιδιακής μεταγραφής του μονοπατιού μετατροπέα σήματος και ενεργοποιητή της μεταγραφής της Janus κινάσης (JAK/STAT). Η πρόσδεση της IFN-α στην επιφάνεια των κυττάρων ενεργοποιεί την JAK, μια κινάση τυροσίνης, ώστε να φωσφορυλιώσει τις STAT1 και STAT2 (Asmana Ningrum, 2014).
Αφού φωσφορυλιωθούν, οι STATs αυτοί σχηματίζουν σύμπλοκο με τον IRF9, έναν από μια οικογένεια IRFs που διαδραματίζουν ένα ευρύ φάσμα ρόλων στη ρύθμιση των ογκογονιδίων και σε άλλες κυτταρικές λειτουργίες (Takaoka et al., 2008). Αυτό το σύμπλοκο, που ονομάζεται IFN-stimulated gene factor 3 (ISGF3), μετατοπίζεται στον πυρήνα του κυττάρου για να ενισχύσει την έκφραση τουλάχιστον 150 γονιδίων (Schneider et al., 2014).
Έχει προταθεί ότι ο IRF9 είναι το πρωταρχικό μέλος της οικογένειας πρωτεϊνών IRF που ευθύνεται για την ενεργοποίηση των αντιπολλαπλασιαστικών επιδράσεων της IFN-α, και αυτό φαίνεται να γίνεται μέσω της σύνδεσής του με τους υποδοχείς 1 και 2 (TRAIL-R1/2) του συνδέτη 1 και 2 του παράγοντα νέκρωσης όγκων που προκαλεί απόπτωση (TRAIL) (Tsuno et al., 2009).
Ο IRF7 είναι ένα άλλο κρίσιμο μέλος της οικογένειας πρωτεϊνών IRF που εμπλέκεται νωρίς στην απόκριση σε μια ιογενή λοίμωξη. Εκφράζεται κανονικά σε χαμηλές ποσότητες, αλλά επάγεται έντονα από τον ISGF3. Ο IRF7 υφίσταται επίσης φωσφορυλίωση σερίνης και πυρηνική μετατόπιση για την περαιτέρω ενεργοποίηση της ανοσολογικής απόκρισης. Ο IRF7 έχει πολύ μικρό χρόνο ημιζωής, οπότε η διαδικασία επαγωγής του γονιδίου του είναι παροδική, ίσως για να αποφευχθεί η υπερέκφραση των IFNs (Honda et al., 2006).
Μόλις το TRAIL δεσμευτεί από τον IRF9, μπορεί στη συνέχεια να δράσει ως συνδέτης για τον υποδοχέα θανάτου 4 (DR4) ή DR5, ξεκινώντας μια αλυσίδα γεγονότων που περιλαμβάνουν την παραγωγή κασπάσης 8 και κασπάσης 3 και τελικά πυροδοτώντας την απόπτωση (Sayers, 2011). Η απορρύθμιση αυτού του μονοπατιού, μέσω της καταστολής είτε της IFN-α είτε του IRF9 και της επακόλουθης αποτυχίας δέσμευσης του TRAIL-R, έχει συσχετιστεί με διάφορες αιματολογικές κακοήθειες (Testa, 2010) και έχει αποδειχθεί ότι αυξάνει το μεταστατικό δυναμικό σε ζωικά μοντέλα μελανώματος, καρκίνου του παχέος εντέρου και λεμφώματος (Finnberg and El-Deiry, 2008).
Η IFN-α εκκινεί και ενορχηστρώνει ένα ευρύ φάσμα ρόλων καταστολής του καρκίνου. Οι Dunn et al. (2005) έδειξαν ότι η IFN-α διαδραματίζει ενεργό ρόλο στην ανοσοδιέγερση του καρκίνου, με τόπο δράσης τα αιμοποιητικά κύτταρα που “προγραμματίζονται” μέσω της πρόσδεσης της IFN-α για την επιτήρηση του όγκου. Μέσω των εξαιρετικά πολύπλοκων αλληλεπιδράσεων μεταξύ των IFN τύπου Ι και των IRF7 και IRF9 ειδικότερα πραγματοποιείται μεγάλο μέρος των αντιπολλαπλασιαστικών επιδράσεων. Αυτό αποδεικνύεται από τον μεγάλο αριθμό μελετών που δείχνουν αυξημένη ανάπτυξη όγκων και/ή μεταστάσεις που σχετίζονται με μεγάλο αριθμό τύπων καρκίνου.
Για παράδειγμα, οι Bidwell et al. (2012) διαπίστωσαν ότι, μεταξύ περισσότερων από 800 ασθενών με καρκίνο του μαστού, εκείνες με υψηλή έκφραση γονιδίων που ρυθμίζονται από τον IRF7 είχαν σημαντικά λιγότερες οστικές μεταστάσεις και προτείνουν την αξιολόγηση αυτών των υπογραφών γονιδίων που σχετίζονται με τον IRF7 ως έναν τρόπο πρόβλεψης εκείνων που διατρέχουν τον μεγαλύτερο κίνδυνο.
Η χρήση microRNA για τη στόχευση της έκφρασης του IRF7 έχει επίσης αποδειχθεί ότι ενισχύει τον πολλαπλασιασμό και την εισβολή των καρκινικών κυττάρων του μαστού in vitro (Li et al., 2015). Οι Zhao κ.ά. (2017) διαπίστωσαν παρόμοιο ρόλο για τον IRF7 σε σχέση με τις οστικές μεταστάσεις σε ένα μοντέλο ποντικού για τον καρκίνο του προστάτη.
Όσον αφορά τον αντικαρκινικό μηχανισμό που κρύβεται πίσω από την έκφραση του IRF7, οι Solis et al. (2006) διαπίστωσαν ότι ο IRF7 επάγει τη μεταγραφή πολλαπλών γονιδίων και τη μετάφραση των πρωτεϊνικών προϊόντων τους που ακολουθούν, συμπεριλαμβανομένων των TRAIL, IL-15, ISG-56 και CD80, με τις σημειωμένες θεραπευτικές επιπτώσεις.
Ο IRF9, επίσης, διαδραματίζει κεντρικό ρόλο στην επιτήρηση και την πρόληψη του καρκίνου. Οι Erb et al. (2013) απέδειξαν ότι ο IRF9 είναι ο μεσολαβητής μέσω του οποίου η IL-6 ενισχύει τις αντιπολλαπλασιαστικές επιδράσεις της IFN-α έναντι των καρκινικών κυττάρων του προστάτη. Οι Tian κ.ά. (2018) διαπίστωσαν ότι ο IRF9 αποτελεί βασικό αρνητικό ρυθμιστή του πολλαπλασιασμού των κυττάρων οξείας μυελοειδούς λευχαιμίας και της αποφυγής της απόπτωσης. Αυτό επιτυγχάνεται, τουλάχιστον εν μέρει, μέσω της ακετυλίωσης της κύριας ρυθμιστικής πρωτεΐνης p53.
Τόσο η IFN-α όσο και ο IRF9 είναι επίσης προφανώς απαραίτητοι για τις ιδιότητες πρόληψης του καρκίνου ενός πλήρως λειτουργικού γονιδίου BRCA2. Σε μια μελέτη που παρουσιάστηκε ως περίληψη στο First AACR International Conference on Frontiers in Basic Cancer Research, οι Mittal και Chaudhuri (2009) περιγράφουν μια σειρά δοκιμών που δείχνουν για πρώτη φορά ότι η έκφραση του BRCA2 οδηγεί σε αυξημένη παραγωγή IFN-α και αυξάνει το μονοπάτι μεταγωγής σήματος που οδηγεί στη σύμπλεξη των IRF9, STAT1 και STAT2 που περιγράφηκε προηγουμένως.
Δύο χρόνια νωρίτερα, οι Buckley et al. (2007) είχαν διαπιστώσει ότι η BRCA1 σε συνδυασμό με την IFN-γ προάγει την IFN τύπου Ι και την επακόλουθη παραγωγή των IRF7, STAT1 και STAT2. Έτσι, τα εξαιρετικά σημαντικά ρυθμιστικά γονίδια του καρκίνου BRCA1 και BRCA2 βασίζονται στον IRF7 και στον IRF9, αντίστοιχα, για να ασκήσουν τις προστατευτικές τους επιδράσεις.
Οι Rasmussen κ.ά. (2021) εξέτασαν τα αδιάσειστα στοιχεία που αποδεικνύουν ότι οι ελλείψεις είτε του IRF7 είτε του IRF9 οδηγούν σε σημαντικά μεγαλύτερο κίνδυνο σοβαρής ασθένειας COVID-19. Είναι σημαντικό ότι επισημαίνουν επίσης ότι τα στοιχεία υποδεικνύουν ότι οι IFN τύπου Ι διαδραματίζουν έναν μοναδικό σημαντικό ρόλο στην προστατευτική ανοσία έναντι της ασθένειας COVID-19, έναν ρόλο που μοιράζονται πολλαπλές κυτταροκίνες στις περισσότερες άλλες ιογενείς ασθένειες, συμπεριλαμβανομένης της γρίπης.
Όπως θα συζητηθεί λεπτομερέστερα παρακάτω, η γλυκοπρωτεΐνη SARS-CoV-2 spike τροποποιεί την παραγωγή εξωσωμάτων από τα κύτταρα του ξενιστή. Η διαμόλυνση των κυττάρων με το γονίδιο της πρωτεΐνης spike και η επακόλουθη παραγωγή της πρωτεΐνης spike του SARS-CoV-2 έχει ως αποτέλεσμα τα εν λόγω κύτταρα να παράγουν εξωσώματα που περιέχουν microRNAs που καταστέλλουν την παραγωγή του IRF9, ενώ ενεργοποιούν μια σειρά από μεταγραφές προφλεγμονωδών γονιδίων (Mishra and Banerjea, 2021). Δεδομένου ότι αυτά τα εμβόλια έχουν σχεδιαστεί ειδικά για να επάγουν υψηλή και συνεχή παραγωγή γλυκοπρωτεϊνών SARS-CoV-2 spike, οι επιπτώσεις είναι δυσοίωνες.
Όπως περιγράφεται παραπάνω, η αναστολή του IRF9 θα καταστείλει το TRAIL και όλες τις ρυθμιστικές και μεταγενέστερες επιδράσεις του που προκαλούν απόπτωση. Η καταστολή του IRF9 μέσω εξωσωματικού microRNA θα πρέπει επίσης να αναμένεται να μειώσει τις αντικαρκινικές προστατευτικές επιδράσεις της δραστηριότητας του γονιδίου BRCA2, το οποίο εξαρτάται από το εν λόγω μόριο για τη δραστηριότητά του, όπως περιγράφηκε παραπάνω.
Οι καρκίνοι που σχετίζονται με το BRCA2 περιλαμβάνουν τον καρκίνο του μαστού, των σαλπίγγων και των ωοθηκών για τις γυναίκες, τον καρκίνο του προστάτη και του μαστού για τους άνδρες, την οξεία μυελοειδή λευχαιμία στα παιδιά και άλλους (National Cancer Institute, 2021).
Ο εμβολιασμός έχει επίσης αποδειχθεί ότι καταστέλλει τόσο τον IRF7 όσο και τον STAT2 (Liu et al., 2021). Αυτό αναμένεται να παρεμβαίνει στις αντικαρκινικές προστατευτικές επιδράσεις του BRCA1, όπως περιγράφεται παραπάνω. Οι καρκίνοι που σχετίζονται με τη μειωμένη δραστηριότητα του BRCA1 περιλαμβάνουν τον καρκίνο του μαστού, της μήτρας και των ωοθηκών στις γυναίκες, τον καρκίνο του προστάτη και του μαστού στους άνδρες και μια μέτρια αύξηση του καρκίνου του παγκρέατος τόσο στους άνδρες όσο και στις γυναίκες (Cancer risk and BRCA1 gene, 2021).
Η μειωμένη έκφραση του BRCA1 συνδέεται τόσο με τον καρκίνο όσο και με τον νευροεκφυλισμό. Το BRCA1 είναι ένα γνωστό γονίδιο ευαισθησίας στον καρκίνο του μαστού. Το BRCA1 αναστέλλει τον πολλαπλασιασμό των καρκινικών κυττάρων του μαστού μέσω της ενεργοποίησης του SIRT1 και της επακόλουθης καταστολής του υποδοχέα ανδρογόνων (Zhang et al., 2016). Σε μια μελέτη που διεξήχθη από τους Suberbielle et al. (2015), βρέθηκαν μειωμένα επίπεδα του BRCA1 στους εγκεφάλους ασθενών με Αλτσχάιμερ. Επιπλέον, πειράματα με τη μείωση της νευρωνικής BRCA1 στην οδοντωτή έλικα ποντικών έδειξαν ότι οι σπασίματα διπλών αλυσίδων του DNA ήταν αυξημένες, μαζί με νευρωνική συρρίκνωση και διαταραχές στη συναπτική πλαστικότητα, τη μάθηση και τη μνήμη.
Η ανάλυση που περιγράφεται λεπτομερώς σε μια πρόσφατη μελέτη περίπτωσης σε έναν ασθενή που διαγνώστηκε με μια σπάνια μορφή λεμφώματος που ονομάζεται αγγειοανοσοβλαστικό λέμφωμα Τ κυττάρων παρείχε ισχυρές ενδείξεις για απροσδόκητη ταχεία εξέλιξη των λεμφωματικών αλλοιώσεων μετά τη χορήγηση της αναμνηστικής ένεσης του mRNA BNT162b2 (Goldman et al., 2021). Οι συγκρίσεις των λεπτομερών μετρήσεων για τις υπερμεταβολικές αλλοιώσεις που πραγματοποιήθηκαν αμέσως πριν και 21 ημέρες μετά την αναμνηστική δόση του εμβολίου αποκάλυψαν πενταπλάσια αύξηση μετά το εμβόλιο, με τη δοκιμή μετά την αναμνηστική δόση να αποκαλύπτει 2 φορές υψηλότερο επίπεδο δραστηριότητας στη δεξιά μασχάλη σε σύγκριση με την αριστερή. Το εμβόλιο είχε χορηγηθεί με ένεση στη δεξιά πλευρά. Αξίζει να επισημανθεί εν προκειμένω ότι οι λεμφοειδείς κακοήθειες έχουν συσχετιστεί με καταστολή του TRAIL-R1 (MacFarlane et al., 2005).
Δεδομένης της παγκοσμίως αναγνωρισμένης σημασίας της βέλτιστης λειτουργίας του BRCA1/2 για την πρόληψη του καρκίνου και δεδομένου του κεντρικού ρόλου που διαδραματίζει το μονοπάτι μεταγωγής σήματος TRAIL για την πρόσθετη επιτήρηση του καρκίνου, η καταστολή των IRF7 και IRF9 μέσω του εμβολιασμού και της επακόλουθης παραγωγής γλυκοπρωτεΐνης ακίδας SARS-CoV-2 είναι εξαιρετικά ανησυχητική για τον μακροχρόνιο έλεγχο του καρκίνου σε πληθυσμούς που έκαναν ένεση με γενετικό εμβόλιο SARS-CoV-2 mRNA.
3. Προβληματισμοί για το σχεδιασμό των εμβολίων mRNA
Τις τελευταίες τρεις δεκαετίες, η τεχνολογική πλατφόρμα mRNA με στόχο την ανάπτυξη αποτελεσματικών και ασφαλών θεραπευτικών εργαλείων νουκλεϊκών οξέων λέγεται ότι έχει ξεπεράσει σοβαρά εμπόδια σχετικά με την αστάθεια του κωδικοποιημένου προϊόντος, τη συντριπτική έμφυτη ανοσογονικότητα και τις μεθοδολογίες χορήγησης (Pardi et al., 2018). Μια από τις σημαντικότερες επιτυχίες της χρήσης του mRNA ως εργαλείου γενετικού εμβολιασμού αφορά την εισαγωγή ισχυρής ανοσίας κατά του καρκίνου (Van Lint et al., 2015). Επιπλέον, η δυνατότητα των mRNAs να αποκαθιστούν ή να αντικαθιστούν διάφορους τύπους πρωτεϊνών σε περιπτώσεις σπάνιων γενετικών μεταβολικών διαταραχών όπως η νόσος Fabry έχει προσφέρει μεγάλες δυνητικές θεραπευτικές εναλλακτικές λύσεις όπου κανένα άλλο φάρμακο δεν έχει αποδειχθεί επιτυχές (Martini and Guey, 2019). Ωστόσο, στην περίπτωση της χρήσης mRNA ως γενετικών εμβολίων κατά μολυσματικών ασθενειών, οι προκαταρκτικές έρευνες για την ασφάλεια φάνηκαν πρόωρες για μια παγκόσμια χρήση στον γενικό πληθυσμό (Pardi et al., 2018– Doulberis et al., 2021).
Παρόλο που υπάρχουν ουσιώδεις επίτοποι σε άλλες πρωτεΐνες του SARS-CoV-2, όπου μια αντισωματική απόκριση θα μπορούσε να παρέχει ουσιαστική ανοσογονικότητα, γνωστές από τον SARS-CoV-1 (Gordon et al., 2020), ο πρωταρχικός στόχος των σχεδιαστών των mRNA εμβολίων SARS-CoV-2 ήταν να σχεδιάσουν ένα εμβόλιο που θα μπορούσε να προκαλέσει μια ισχυρή αντισωματική απόκριση αποκλειστικά στη γλυκοπρωτεΐνη spike. Αυτά τα αντισώματα, ιδίως τα IgA στο ρινοφάρυγγα, θα έπρεπε να προκαλούν τη γρήγορη απομάκρυνση των εισβολέων ιών πριν μπορέσουν να εισβάλουν στα κύτταρα του ξενιστή, σταματώντας έτσι τη διαδικασία της νόσου από νωρίς. Όπως αναφέρεται συνοπτικά από τους Kaczmarek et al. (2021):
“Η λογική πίσω από τον εμβολιασμό είναι να παρέχεται σε κάθε εμβολιαζόμενο άτομο προστασία έναντι του ιού SARS-CoV-2. Η προστασία αυτή επιτυγχάνεται με τη διέγερση του ανοσοποιητικού συστήματος ώστε να παράγει αντισώματα κατά του ιού και να αναπτύξει λεμφοκύτταρα που θα διατηρήσουν τη μνήμη και την ικανότητα να καταπολεμούν τον ιό για μεγάλο χρονικό διάστημα”.
Ωστόσο, δεδομένου ότι ο εμβολιασμός χορηγείται παρεντερικά, η IgG είναι η κύρια κατηγορία αντισωμάτων που παράγεται έναντι της γλυκοπρωτεΐνης της ακίδας του SARS-CoV-2 και όχι η IgA (Wisnewski et al., 2021).
Τα εμβόλια γενικά εξαρτώνται από βοηθητικές ουσίες όπως το αλουμίνιο και το σκουαλένιο για να προκαλέσουν τη μετανάστευση των κυττάρων του ανοσοποιητικού συστήματος στο σημείο της ένεσης αμέσως μετά τον εμβολιασμό. Στην ιστορία της ανάπτυξης εμβολίων mRNA, αρχικά υπήρχε η ελπίδα ότι το ίδιο το mRNA θα μπορούσε να χρησιμεύσει ως το δικό του επικουρικό. Αυτό οφείλεται στο γεγονός ότι τα ανθρώπινα κύτταρα αναγνωρίζουν το ιικό RNA ως ξένο και αυτό οδηγεί σε ρύθμιση των IFN τύπου Ι, που μεσολαβεί μέσω υποδοχέων τύπου toll, όπως οι TLR3, TLR7 και TLR8 (Karik ó et al., 2005).
Ωστόσο, με την πάροδο του χρόνου κατέστη σαφές ότι υπήρχαν προβλήματα με αυτή την προσέγγιση, τόσο επειδή η έντονη αντίδραση θα μπορούσε να προκαλέσει συμπτώματα που μοιάζουν με γρίπη όσο και επειδή η IFN-α θα μπορούσε να δρομολογήσει μια αλυσιδωτή αντίδραση που θα οδηγούσε στη διάσπαση του mRNA πριν αυτό μπορέσει να παράγει επαρκείς ποσότητες γλυκοπρωτεΐνης SARS-CoV-2 spike για την πρόκληση ανοσολογικής απάντησης (de Beuckelaer et al., 2016). Η επανάσταση ήρθε όταν ανακαλύφθηκε πειραματικά ότι το mRNA που κωδικοποιεί την πρωτεΐνη spike θα μπορούσε να τροποποιηθεί με συγκεκριμένους τρόπους που ουσιαστικά θα ξεγελούσαν τα ανθρώπινα κύτταρα ώστε να το αναγνωρίσουν ως ακίνδυνο ανθρώπινο RNA. Μια σημαντική δημοσίευση των Karikó κ.ά. (2005) κατέδειξε μέσω μιας σειράς πειραμάτων in vitro ότι μια απλή τροποποίηση του mRNA, έτσι ώστε όλες οι ουριδίνες να αντικατασταθούν με ψευδοουριδίνη, θα μπορούσε να μειώσει δραματικά την ενεργοποίηση του έμφυτου ανοσοποιητικού έναντι του εξωγενούς mRNA. Οι Andries κ.ά. (2015) ανακάλυψαν αργότερα ότι η 1-μεθυλοψευδοουριδίνη ως αντικατάσταση της ουριδίνης ήταν ακόμη πιο αποτελεσματική από την ψευδοουριδίνη και μπορούσε ουσιαστικά να καταργήσει την απόκριση TLR στο mRNA, αποτρέποντας την ενεργοποίηση των δενδριτικών κυττάρων που προέρχονται από το αίμα. Αυτή η τροποποίηση εφαρμόζεται και στα δύο εμβόλια mRNA που κυκλοφορούν στην αγορά (Park et al., 2021).
Μάλλον προφητικά, η εκτενής ανασκόπηση των Forni και Mantovani (2021) έθεσε σοβαρά ερωτήματα σχετικά με την ανάπτυξη της έμφυτης ανοσίας από τους γενετικούς εμβολιασμούς με mRNA SARS-CoV-2. Όπως δήλωσαν οι συγγραφείς: “Λόγω του σύντομου χρόνου ανάπτυξης και της καινοτομίας των τεχνολογιών που υιοθετήθηκαν, τα εμβόλια αυτά θα αναπτυχθούν με αρκετά άλυτα ζητήματα που μόνο η πάροδος του χρόνου θα επιτρέψει να διευκρινιστούν”. Στη συνέχεια, οι συγγραφείς συνέστησαν να συμπεριληφθούν ορισμένα μόρια, όπως η μακρά πεντραξίνη PTX3, ως αντιπροσωπευτικοί δείκτες χυμικής ανοσίας για την αξιολόγηση της πρώιμης ενεργοποίησης των μηχανισμών της έμφυτης ανοσίας και της υποκείμενης αντιδραστικότητας στο πλαίσιο των πρωτοκόλλων της κοινοπραξίας BIOVACSAFE (Forni and Mantovani, 2021– Weiner et al., 2019). Ωστόσο, εξ όσων γνωρίζουμε, αυτά τα πρωτόκολλα ασφαλείας δεν έχουν συμπεριληφθεί στην αξιολόγηση της επαγόμενης έμφυτης ανοσίας από τα γενετικά εμβόλια mRNA SARS-CoV-2 (Mulligan et al., 2020).
Εν προκειμένω, στην περίπτωση του εμβολίου SARS-CoV-2 BNT162b2 mRNA, σε αντίθεση με την ανοσολογική απόκριση που επάγεται από τη φυσική λοίμωξη SARS-CoV-2, όπου παρατηρείται μια ισχυρή απόκριση ιντερφερόνης, τα άτομα που εμβολιάστηκαν με εμβόλια BNT162b2 mRNA ανέπτυξαν μια ισχυρή προσαρμοστική ανοσολογική απόκριση η οποία περιοριζόταν μόνο στα κύτταρα μνήμης, δηλαδή μια εναλλακτική οδό ανοσολογικής απόκρισης που παρέκαμψε τις μεσολαβούμενες από την IFN οδούς (Mulligan et al., 2020). Επιπλέον, λόγω μεταγενέστερων μεταλλάξεων στην πρωτεΐνη ακίδας του SARS-CoV-2, παρατηρείται σημαντική απώλεια των εξουδετερωτικών αντισωμάτων που επάγονται από το εμβόλιο BNT162b2 mRNA σε σύγκριση με αυτά που χορηγούνται μόνο από τις μεταλλάξεις του SARS-CoV-2 (Collier et al., 2021). Από την άποψη αυτή, όπως παραδέχονται οι κατασκευαστές του εμβολίου: “Το RNA του εμβολίου μπορεί να τροποποιηθεί με την ενσωμάτωση 1-μεθυλοψευδοουριδίνης, η οποία εξασθενεί την αίσθηση του έμφυτου ανοσοποιητικού συστήματος και αυξάνει τη μετάφραση του mRNA in vivo”. (Mulligan et al., 2020– Katalin Karikó et al., 2008). Λαμβάνοντας υπόψη τις πολλαπλές μεταλλάξεις που αναπτύσσει ο SARS-CoV-2, όπως για παράδειγμα στα κρούσματα της Βραζιλίας (Timmers et al., 2021), μια αποτελεσματική ανοσολογική απόκριση που αποτρέπει την εξάπλωση των μεταλλάξεων του SARS-CoV2 περιλαμβάνει αναγκαστικά την ανάπτυξη μιας ισχυρής απόκρισης IFN-I ως μέρος του έμφυτου ανοσοποιητικού συστήματος. Αυτή η απόκριση απαιτεί επίσης τη συμμετοχή μιας λειτουργικής απόκρισης NF-κΒ. Δυστυχώς, η υπερέκφραση της γλυκοπρωτεΐνης spike διαλύει τις αποκρίσεις του μονοπατιού NF-κB και αυτό το μοριακό γεγονός μπορεί να ενισχυθεί από mRNA που κωδικοποιούν την πρωτεΐνη spike (Kyriakopoulos and McCullough, 2021– Jiang and Mei, 2021).
Για τον επιτυχή σχεδιασμό εμβολίων mRNA, το mRNA πρέπει να ενθυλακωθεί σε προσεκτικά κατασκευασμένα σωματίδια που μπορούν να προστατεύσουν το RNA από την αποικοδόμηση από τις αποπολυμεράσες RNA. Τα εμβόλια mRNA διαμορφώνονται ως λιπιδικά νανοσωματίδια που περιέχουν χοληστερόλη και φωσφολιπίδια, με το τροποποιημένο mRNA να συμπλέκεται με έναν εξαιρετικά τροποποιημένο λιπιδικό κορμό πολυαιθυλενογλυκόλης (PEG) για να προωθείται η έγκαιρη απελευθέρωσή του από το ενδοσωμάτιο και να προστατεύεται περαιτέρω από την αποικοδόμηση (Hou et al., 2021). Οι υπάρχοντες βιολογικοί μηχανισμοί του κυττάρου ξενιστή συνεργάζονται για να διευκολύνουν τη φυσική παραγωγή πρωτεΐνης από το mRNA μέσω της ενδοσωματικής πρόσληψης ενός λιπιδικού σωματιδίου (Hou et al., 2021). Προστίθεται επίσης ένα συνθετικό κατιονικό λιπίδιο, καθώς έχει αποδειχθεί πειραματικά ότι λειτουργεί ως βοηθητικό για την προσέλκυση ανοσοποιητικών κυττάρων στο σημείο της ένεσης και τη διευκόλυνση της ενδοσωματικής διαφυγής. Οι de Beuckelaer et al. (2016) παρατήρησαν ότι “η συμπύκνωση του mRNA σε κατιονικά λιποπλέγματα αυξάνει την ισχύ της απόκρισης των Τ κυττάρων που προκαλεί το εμβόλιο mRNA κατά πολλές τάξεις μεγέθους”. Μια άλλη σημαντική τροποποίηση είναι ότι αντικατέστησαν τον κώδικα για δύο γειτονικά αμινοξέα στο γονιδίωμα με κώδικες για προλίνη, γεγονός που προκαλεί την παραμονή της γλυκοπρωτεΐνης αιχμής σε μια σταθεροποιημένη μορφή πριν από τη σύντηξη (Wrapp et al., 2020).
Το mRNA της γλυκοπρωτεΐνης spike του SARS-CoV-2 “εξανθρωπίζεται” περαιτέρω με την προσθήκη ενός καλύμματος με μεθυλιωμένη γουανίνη, 3′ και 5′ αμετάφραστες περιοχές (UTR) που αντιγράφονται από εκείνες των ανθρώπινων πρωτεϊνών και, τέλος, μια μακριά ουρά poly(A) για την περαιτέρω σταθεροποίηση του RNA (Kyriakopoulos and McCullough, 2021).
Συγκεκριμένα, οι ερευνητές επέλεξαν έξυπνα την 3′UTR που ελήφθη από τις σφαιρίνες, οι οποίες παράγονται σε μεγάλες ποσότητες από τα ερυθροκύτταρα, επειδή είναι πολύ αποτελεσματική στην προστασία του mRNA από την αποικοδόμηση και στη διατήρηση της διαρκούς παραγωγής πρωτεϊνών (Orlandini von Niessen et al., 2019). Αυτό είναι αναμενόμενο, δεδομένου ότι τα ερυθροκύτταρα δεν διαθέτουν πυρήνα, οπότε δεν είναι σε θέση να αντικαταστήσουν τα mRNA όταν καταστραφούν.
Τόσο το εμβόλιο Moderna όσο και το εμβόλιο Pfizer υιοθέτησαν μια 3′UTR από τις σφαιρίνες, ενώ το εμβόλιο Pfizer χρησιμοποιεί επίσης μια ελαφρώς τροποποιημένη 5′UTR σφαιρίνης (Xia, 2021). Οι de Beuckelaer et al. (2016) συνόψισαν εύστοχα τις συνέπειες αυτών των τροποποιήσεων ως εξής: “Τα τελευταία χρόνια, οι τεχνικές βελτιώσεις στον τρόπο παρασκευής των mRNAs IVT [in vitro transcribed] (τροποποιήσεις του 5′ Cap, βελτιστοποιημένη περιεκτικότητα σε GC, βελτιωμένες ουρές polyA, σταθεροποιητικές UTRs) έχουν αυξήσει τη σταθερότητα των mRNAs IVT σε τέτοιο βαθμό που η πρωτεϊνική έκφραση μπορεί πλέον να επιτευχθεί για ημέρες μετά την άμεση in vivo χορήγηση του mRNA”.
Ωστόσο, ο βελτιστοποιημένος ανάλογος σχηματισμός καλύμματος των συνθετικών mRNA αναγκάζει αναπόφευκτα τα κύτταρα-δέκτες να υποβληθούν σε μια εξαρτώμενη από το κάλυμμα παρατεταμένη μετάφραση, αγνοώντας τις ομοιοστατικές απαιτήσεις της κυτταρικής φυσιολογίας (Kyriakopoulos and McCullough, 2021). Η μεθυλίωση cap 2′-O που πραγματοποιείται από τη μεθυλοτρανσφεράση cap 2′-O (CMTR1) χρησιμεύει ως μοτίβο που χαρακτηρίζει το mRNA ως “αυτο”, ώστε να αποτρέπεται η αναγνώριση από τις πρωτεΐνες πρόσδεσης RNA που προκαλούνται από την IFN (Williams et al., 2020).
Έτσι, το mRNA στα εμβόλια, εξοπλισμένο με το μοτίβο μεθυλίωσης cap 2′-Ο, αποφεύγει την ανίχνευση ως ιική εισβολή. Επιπλέον, η συντριπτική ώθηση των κυττάρων να εκτελέσουν μια ενιαία και τεχνητή προσέγγιση της μετάφρασης σύμφωνα με το ισχυρό κάλυμμα και τις συνθετικές μεθυλιώσεις των mRNA στα εμβόλια συνδέεται θεμελιωδώς με την εξέλιξη της νόσου λόγω της διαφορικής και όχι της φυσιολογικής σηματοδότησης των υποδοχέων αναγνώρισης προτύπων (PRRs) (Leung and Amarasinghe, 2016).
Η ρυθμιστική διαδικασία που ελέγχει τη μετάφραση του mRNA είναι εξαιρετικά πολύπλοκη και διαταράσσεται έντονα σε σχέση με τα εμβόλια mRNA (Kyriakopoulos and McCullough, 2021– Leung and Amarasinghe, 2016). Εν συντομία, η ιδέα είναι τα εμβόλια mRNA να επιτυγχάνουν τον επιδιωκόμενο στόχο (δηλαδή την παραγωγή της τροποποιημένης πρωτεΐνης spike) μέσω μιας stealth στρατηγικής που παρακάμπτει τη φυσική ανοσολογική απόκριση στη ιογενή λοίμωξη τύπου RNA.
Τα εγχυόμενα λιπιδικά νανοσωματίδια που περιέχουν mRNA μεταφέρονται στο εσωτερικό του κυττάρου μέσω ενδοκυττάρωσης. Το mRNA διαφεύγει από τον λιπιδικό φορέα του και μεταναστεύει στο ριβόσωμα, όπου μεταφράζεται σε αφθονία στο τελικό πρωτεϊνικό προϊόν του, ακολουθώντας ένα βελτιστοποιημένο πρόγραμμα για την παραγωγή μεγάλων ποσοτήτων μιας συγκεκριμένης πρωτεΐνης για παρατεταμένο χρονικό διάστημα.
Αυτές οι τροποποιημένες γλυκοπρωτεΐνες ακίδας SARS-CoV-2 ακολουθούν στη συνέχεια μία από τις τρεις κύριες οδούς. Ορισμένες αποικοδομούνται πρωτεολυτικά και θραύσματα δεσμεύονται από μόρια MHC τάξης Ι για επιφανειακή παρουσίαση σε κυτταροτοξικά Τ-κύτταρα.
Σε μια δεύτερη οδό τα ίδια θραύσματα γλυκοπρωτεϊνών αιχμής δεσμεύουν μόρια MHC τάξης ΙΙ, μετακινούνται στην επιφάνεια των κυττάρων και ενεργοποιούν τα Τ-βοηθητικά κύτταρα. Μια τελική οδός έχει διαλυτές γλυκοπρωτεΐνες ακίδας που εξωθούνται από το κύτταρο σε εξωσώματα, όπου μπορούν να αναγνωριστούν από ειδικά για τις γλυκοπρωτεΐνες ακίδας αντισώματα που ενεργοποιούνται από τα Β-κύτταρα (Chaudhary et al., 2021).
Μια πρόσφατη μελέτη πρώιμης απελευθέρωσης διαπίστωσε ότι το mRNA στα εμβόλια COVID-19 είναι παρόν στα βλαστικά κέντρα του δευτερογενούς λεμφικού ιστού για μεγάλο χρονικό διάστημα μετά τη χορήγηση του εμβολίου και ότι συνεχίζει να συνθέτει γλυκοπρωτεΐνη spike έως και τουλάχιστον εξήντα ημέρες μετά τον εμβολιασμό (Röltgen et al., 2022).
Αυτό υποδηλώνει ότι τα ανοσοκύτταρα που προσλαμβάνουν το mRNA στον μυ του βραχίονα μεταναστεύουν στο λεμφικό σύστημα στους λεμφαδένες, πιθανώς για να εκθέσουν τα Β-κύτταρα και τα Τ-κύτταρα στο τοξικό αντιγόνο. Η παραμονή του mRNA στους λεμφαδένες και η συνεχής σύνθεση της γλυκοπρωτεΐνης ακίδας SARS-CoV-2 αντανακλούν την ευφυή μηχανική που εμπλέκεται στην τεχνολογία του mRNA, όπως περιγράφεται ανωτέρω.
Τελικά, μέσω της χρήσης νανολιπιδίων και της εξελιγμένης τεχνολογίας mRNA παρακάμπτεται η φυσιολογική ανοσολογική απόκριση σε εξωγενές RNA, προκειμένου να παραχθεί μια ισχυρή αντισωματική απόκριση έναντι ενός εξωγενούς ιού RNA.
4. Εμπλουτισμός GC και πιθανές δομές G4 (pG4) σε mRNA εμβολίων
Πρόσφατα, μέλη της ομάδας μας διερεύνησαν πιθανές μεταβολές στη δευτεροταγή δομή των mRNAs στα εμβόλια SARS-CoV-2 λόγω βελτιστοποίησης των κωδικονίων των συνθετικών μεταγράφων mRNA (McKernan et al., 2021). Η μελέτη αυτή έδειξε ότι υπάρχει σημαντικός εμπλουτισμός της περιεκτικότητας σε GC στα mRNAs των εμβολίων (53% στο BNT162b2 και 61% στο Moderna mRNA-1273) σε σύγκριση με το εγγενές mRNA του SARS-CoV-2 (36%).
Η εμπλουτισμένη περιεκτικότητα των mRNAs σε GC είναι το αποτέλεσμα της βελτιστοποίησης των κωδικονίων που πραγματοποιήθηκε κατά την ανάπτυξη των mRNAs που χρησιμοποιούνται στα εμβόλια SARS-CoV-2, προφανώς χωρίς να προσδιοριστεί η επίδραση στις δευτεροταγείς δομές, ιδίως στο σχηματισμό τετραπλέγματος γουανίνης (G quadruplex) (McKernan et al., 2021).
Η βελτιστοποίηση κωδικονίου περιγράφει την παραγωγή συνθετικών, βελτιστοποιημένων ως προς το κωδικόνιο πολυπεπτιδίων και πρωτεϊνών που χρησιμοποιούνται σε βιοτεχνολογικές θεραπευτικές ουσίες (όπως τα συνθετικά mRNA που χρησιμοποιούνται για τον εμβολιασμό SARS-CoV-2). Οι τροποποιημένες αναθέσεις κωδικονίων εντός του προτύπου mRNA αυξάνουν δραματικά την ποσότητα των παραγόμενων πολυπεπτιδίων ή/και πρωτεϊνών (Mauro and Chappell, 2014).
Η αντικατάσταση συνώνυμων κωδικονίων έχει επίσης ως αποτέλεσμα την αλλαγή των πολυλειτουργικών ρυθμιστικών και δομικών ρόλων των πρωτεϊνών που προκύπτουν (Shabalina et al., 2013). Για το λόγο αυτό, η βελτιστοποίηση κωδικονίων έχει επιφυλαχθεί λόγω των επακόλουθων αλλαγών που προκαλεί διαταραχή στη δευτερογενή διαμόρφωση των πρωτεϊνικών προϊόντων με δυνητικά καταστροφικές συνέπειες στην προκύπτουσα ανοσογονικότητα, αποτελεσματικότητα και λειτουργία τους (Zhou et al., 2013; Agashe et al., 2013). Αξίζει να σημειωθεί ότι διάφορες ανθρώπινες ασθένειες είναι αποτέλεσμα συνώνυμων νουκλεοτιδικών πολυμορφισμών (McCarthy et al., 2017).
Σε ένα πείραμα όπου οι πλούσιες σε GC και οι φτωχές σε GC εκδοχές των μεταγράφων mRNA για την πρωτεΐνη θερμικού σοκ 70 διαμορφώθηκαν στο πλαίσιο πανομοιότυπων υποκινητών και αλληλουχιών UTR, διαπιστώθηκε ότι τα πλούσια σε GC γονίδια εκφράζονταν πολλαπλάσια έως πάνω από εκατονταπλάσια αποτελεσματικά από τα αντίστοιχα φτωχά σε GC (Kudla et al., 2006). Αυτό οφείλεται εν μέρει στο γεγονός ότι όλα τα προτιμώμενα κωδικόνια των θηλαστικών έχουν νουκλεοτίδια G ή C στην τρίτη θέση.
Είναι επίσης καλά τεκμηριωμένο ότι τα πλούσια σε AU στοιχεία στα 3′ UTR μπορούν να αποσταθεροποιήσουν το mRNA (Otsuka et al., 2019). Αυτό που μπορεί να προκαλεί ιδιαίτερη ανησυχία είναι το γεγονός ότι το περιεχόμενο εμπλουτισμού GC στα mRNA των εμβολίων έχει ως αποτέλεσμα μια αυξημένη ικανότητα για δυνητικούς σχηματισμούς G-τετραπλέγματος (pG4) σε αυτές τις δομές, και αυτό θα μπορούσε να προκαλέσει την εμφάνιση νευρολογικής νόσου (Wang et al., 2021).
Είναι αξιοσημείωτο ότι η γενετική αλληλουχία της ανθρώπινης πρωτεΐνης prion (PrP) περιέχει πολλαπλά μοτίβα σχηματισμού G4 και η παρουσία τους μπορεί να αποτελεί τον χαμένο κρίκο στην αρχική μετατροπή της PrP στην κακώς διπλωμένη μορφή, PrPsc (Olsthoorn, 2014). Η πρόσδεση της PrP στο δικό της mRNA μπορεί να είναι ο σπόρος που προκαλεί την κακή αναδίπλωση της πρωτεΐνης. Η παρατήρηση αυτή είναι ιδιαίτερα ανησυχητική υπό το πρίσμα του γεγονότος ότι η γλυκοπρωτεΐνη spike του SARS-CoV-2 έχει χαρακτηριστικά που μοιάζουν με prion (Tetz and Tetz, 2022).
Από τη μία πλευρά, η περιεκτικότητα σε GC διαδραματίζει βασικό ρόλο στη διαμόρφωση της αποτελεσματικότητας της μετάφρασης και στον έλεγχο της έκφρασης του mRNA στα θηλαστικά (Babendure et al., 2006).
Ειδικά κατά την έναρξη της μετάφρασης, το περιεχόμενο GC που λειτουργεί ως cis-ενεργό στοιχείο του mRNA ενορχηστρώνει την προσκόλληση του ριβοσωματικού συμπλόκου προ-έναρξης 43S και στη συνέχεια τη συναρμολόγηση του συμπλόκου του ευκαρυωτικού παράγοντα έναρξης της μετάφρασης 4F (eIF4F).
Ένα αντιπροσωπευτικό παράδειγμα αυτού του συστήματος σε δράση είναι η ρύθμιση της έκφρασης των mRNA της α και β σφαιρίνης μέσω των 5′ αμετάφραστων περιοχών τους (5′UTRs) (Babendure et al., 2006).
Από την άλλη πλευρά, η παρουσία pG4s σε RNAs εμπλέκεται στη βιολογία του καρκίνου ως βασικός καθοριστικός παράγοντας της ρύθμισης των πρωτεϊνών δέσμευσης G4 RNA, όπως η ελικάση (Herdy et al., 2018). Γενικά, τα G-quadruplexes στα RNAs έχουν ουσιαστικό ρόλο α) στη ρύθμιση της γονιδιακής έκφρασης, β) στον εντοπισμό των ριβονουκλεϊκών πρωτεϊνών, γ) στον εντοπισμό του mRNA και δ) στη ρύθμιση της έκφρασης των πρωτο-ογκογονιδίων (Fay et al., 2017).
Όσον αφορά τον SARS-CoV-2, οι σχετικές μελέτες αποκαλύπτουν συντριπτικές ομοιότητες μεταξύ των pG4s του SARS-CoV-2, συμπεριλαμβανομένου του RNA που κωδικοποιεί τη γλυκοπρωτεΐνη SARS-CoV-2 spike, και εκείνων που έχουν αλληλουχηθεί στο ανθρώπινο μεταγράφημα (Zhang et al., 2020).
Έτσι, μπορεί να συναχθεί το συμπέρασμα ότι τα συνθετικά mRNA στα εμβόλια που φέρουν περισσότερες δομές pG4 στην αλληλουχία κωδικοποίησής τους για τη γλυκοπρωτεΐνη αιχμής SARS-CoV-2 θα ενισχύσουν και θα επιτείνουν την πιθανή μετα-μεταγραφική αποδιοργάνωση που οφείλεται στο εμπλουτισμένο με G4 RNA κατά τη διάρκεια της φυσικής λοίμωξης SARS-CoV-2.
Επιπλέον, η κυτταρική πρωτεΐνη δέσμευσης νουκλεϊκών οξέων (CNBP), η οποία είναι η κύρια κυτταρική πρωτεΐνη που δεσμεύεται στο γονιδίωμα του SARS-CoV-2 RNA σε κύτταρα που έχουν μολυνθεί από τον άνθρωπο (Schmidt et al., 2021), δεσμεύεται και προωθεί την αναδίπλωση των G4 του SARS-CoV-2 που σχηματίζονται τόσο από τις θετικής όσο και από τις αρνητικής κατεύθυνσης πρότυπες αλυσίδες του γονιδιώματος του SARS-CoV-2 RNA.
Μια παρόμοια διαφοροποίηση της CNBP στα G4s του mRNA του εμβολίου και η προώθηση της ισορροπίας των G4 προς μη αναδιπλωμένες διαμορφώσεις δημιουργούν ευνοϊκές συνθήκες για τη σύνδεση miRNA και αυτό θα έχει άμεσο αντίκτυπο στην εξαρτώμενη από miRNA ρύθμιση της γονιδιακής έκφρασης (Rouleau et al., 2017).
Τα RNA αρνητικής έννοιας είναι ενδιάμεσα μόρια που παράγονται από το σύμπλοκο της μεταγραφάσης της αντιγραφής (RTC) που σχηματίζεται από τις μη δομικές πρωτεΐνες των κορονοϊών (συμπεριλαμβανομένου του SARS-CoV-2) για να παρέχουν αποτελεσματικότητα στην αντιγραφή και τη μεταγραφή (Bezzi et al., 2021– Sola et al., 2015). Αυτό, ωστόσο, εισάγει μια άλλη δυνητικά σοβαρή επιπλοκή που σχετίζεται με τον εμβολιασμό.
Η συν-μόλυνση με άλλους ιούς RNA με αρνητική νόσηση, όπως η ηπατίτιδα C (Jaubert et al., 2018) ή η μόλυνση από άλλους κορονοϊούς ταυτόχρονα με τις περιόδους εμβολιασμού, θα παρείχε τον απαραίτητο μηχανισμό RTC για την αναπαραγωγή ενδιάμεσων προϊόντων με αρνητική νόσηση από συνθετικά mRNA και, επομένως, θα ενίσχυε την παρουσία pG4s από πρότυπα με αρνητική νόσηση. Αυτό θα οδηγούσε σε περαιτέρω επιτρανσκριπτονομική απορρύθμιση (Spiegel et al., 2020).
Συνοψίζοντας το θέμα μέχρι αυτό το σημείο, ο εμπλουτισμός της περιεκτικότητας σε GC στο mRNA των εμβολίων θα οδηγήσει αναπόφευκτα σε αύξηση της περιεκτικότητας των εμβολίων σε pG4. Αυτό, με τη σειρά του, θα οδηγήσει σε απορρύθμιση του συστήματος σύνδεσης G4-RNA-πρωτεΐνης και σε ένα ευρύ φάσμα πιθανών κυτταρικών παθολογιών που σχετίζονται με ασθένειες, συμπεριλαμβανομένης της καταστολής της έμφυτης ανοσίας, του νευροεκφυλισμού και του κακοήθους μεταβολισμού (Herdy et al., 2018).
Όσον αφορά τη μετα-μεταφραστική απορρύθμιση λόγω της εμφάνισης νέων δομών G4 που εισάγονται από τον εμβολιασμό, προκύπτει ένα άλλο σημαντικό ζήτημα που σχετίζεται με τη ρύθμιση των miRNA και των pG4s. Στις δομές miRNA εντοπίζονται εκατοντάδες αλληλουχίες pG4 (Rouleau et al., 2018). Στην αναδιπλωμένη διαμόρφωσή τους, όπως κατά την πρόσδεσή τους στους αντίστοιχους στόχους τους στις αλληλουχίες 3′ έως 5′ των mRNAs, τα miRNAs απενεργοποιούν τη μετάφραση του αντίστοιχου mRNA-στόχου τους.
Εναλλακτικά, όταν βρίσκονται παρουσία ενός ligand G4, προάγεται η μετάφραση των mRNA-στόχων τους (Chan et al., 2018). Επιπλέον, ένας τεράστιος αριθμός υποθετικών θέσεων πρόσδεσης miRNA επικαλύπτεται με G4s στα 3′ UTRs των mRNAs, καθώς υπάρχουν τουλάχιστον 521 συγκεκριμένα miRNAs που προβλέπεται να προσδένονται σε τουλάχιστον ένα από αυτά τα G4s. Συνολικά, έχουν εντοπιστεί 44.294 πιθανές θέσεις πρόσδεσης G4-miRNA που διαθέτουν υποθετικές επικαλυπτόμενες G4s στον άνθρωπο (Rouleau et al., 2017).
Όπως περιγράφεται αλλού, κατά τη διάρκεια της κυτταρικής μετάφρασης των mRNA εμβολίων, θα συμβεί αυξημένη συναρμολόγηση ενός αριθμού πρωτεϊνικών ελικαζών που δεσμεύουν RNA, όπως ο eIF4A που συνδέεται με τον eIF4G (Kyriakopoulos and McCullough, 2021). Η παρουσία αυξημένων pG4s στα συνθετικά mRNA μπορεί δυνητικά να ενισχύσει τη σύνδεση των πρωτεϊνών δέσμευσης RNA και των miRNA.
Αυτή η μορφή μοριακής συγκέντρωσης πρωτεϊνικών συστατικών (ελικάσες) με μεγάλη συγγένεια για τη δέσμευση G4 (Rouleau et al., 2017) θα μειώσει τον αριθμό των πρωτεϊνών δέσμευσης RNA που δεσμεύουν G4s που κανονικά είναι διαθέσιμες για τη ρύθμιση των miRNA.
Αυτή η απώλεια των πρωτεϊνών δέσμευσης RNA καθώς και της διαθεσιμότητας των miRNA για ρύθμιση μέσω δέσμευσης σε G4s μπορεί να μεταβάλει δραματικά τη μεταφραστική ρύθμιση των miRNAs που υπάρχουν στα κύτταρα και, ως εκ τούτου, να διαταράξει τη βασική ρύθμιση της έκφρασης των ογκογονιδίων. Ένα παράδειγμα είναι η εξαρτώμενη από την p16 ρύθμιση της ογκοκατασταλτικής πρωτεΐνης p53 (Rouleau et al., 2017– Al-Khalaf and Aboussekhra, 2018).
Αυτή η διαδικασία είναι εξαιρετικά περίπλοκη αλλά ισοδυναμεί με κυτταρική ομοιόσταση. Έτσι, και πάλι, αξίζει να συνοψίσουμε. Εάν συσσωρεύονται pG4s, όπως θα ήταν αναμενόμενο με μια αυξημένη ποσότητα περιεχομένου GC στο mRNA του εμβολίου, αυτό θα είχε ως αποτέλεσμα την αύξηση των δυνητικών δομών G4 που είναι διαθέσιμες κατά τη διάρκεια των μεταφραστικών συμβάντων και αυτό μπορεί να επηρεάσει τη μετα-μεταγραφική ρύθμιση των miRNA.
Αυτό, με τη σειρά του, είτε θα ευνοούσε τη μεγαλύτερη έκφραση των ογκογονιδίων που σχετίζονται με μια σειρά καρκίνων, είτε θα οδηγούσε τα κύτταρα προς την απόπτωση και τον κυτταρικό θάνατο (Weldon et al., 2018). Η μελέτη περιπτώσεων που περιγράφηκε νωρίτερα στο παρόν έγγραφο υποστηρίζει σθεναρά την υπόθεση ότι οι εν λόγω ενέσεις προκαλούν επιταχυνόμενη εξέλιξη λεμφώματος σε θυλακιώδη κύτταρα Β (Goldman et al., 2021).
Τα πρότυπα αναγνώρισης της πρόσδεσης των miRNA είναι ατελώς συμπληρωματικά με τις περιοχές-στόχους τους και για τον λόγο αυτό αναφέρονται ως “κύριοι ρυθμιστές”, καθώς ένα miRNA επηρεάζει πληθώρα διαφορετικών στόχων (Rouleau et al., 2018). Το πλήθος των pG4s στο mRNA του εμβολίου θα λειτουργούσε, όπως ήταν αναμενόμενο, ως δόλωμα, αποσπώντας την προσοχή των miRNAs από την κανονική τους λειτουργία στη ρύθμιση της έκφρασης των ανθρώπινων πρωτεϊνών.
Η αύξηση των στόχων G4 λόγω του εμβολίου θα μείωνε τη διαθεσιμότητα των miRNAs για τη στόχευση των G4 που εκφράζονται από τον άνθρωπο για τη ρύθμιση της γονιδιακής έκφρασης. Αυτό μπορεί να έχει ως αποτέλεσμα την καθοδική ρύθμιση της έκφρασης των miRNA, η οποία εμπλέκεται στην καρδιαγγειακή παθολογία (Small and Olson, 2011), στην έναρξη του νευροεκφυλισμού (Abe and Bonini, 2013) και/ή στην εξέλιξη του καρκίνου (Farazi et al., 2013).
Από τις περισσότερες απόψεις εντός του μηχανισμού της επιτροπογραφίας, τα miRNAs εμπλέκονται στην καταστολή της μετάφρασης. Ένα παράδειγμα, ζωτικής σημασίας για την κυτταρική φυσιολογική λειτουργία, είναι αυτό του Mouse double minute 2 homolog (MDM2), μιας φυσικής αρνητικής ρυθμιστικής πρωτεΐνης της p53. Η ίδια η p53 θεωρείται ο κύριος ρυθμιστής του κυτταρικού δικτύου καταστολής των γονιδίων όγκου.
Η P16 ελέγχει την έκφραση πολλών miRNAs και, μέσω της πρόσδεσης των miR-141 και mIR-146b-5p στο mRNA της MDM2, επάγει την αρνητική ρύθμιση της MDM2, επιτρέποντας έτσι την ουβικουιτινίωση της p53 και την προώθηση της κυτταρικής επιβίωσης μετά από γεγονότα βλάβης του DNA (Al-Khalaf and Aboussekhra, 2018). Η απορρύθμιση των miRNAs που ελέγχουν την καταστολή της p53 από το MDM2 θα οδηγούσε αναμενόμενα σε αυξημένο κίνδυνο για μια σειρά καρκίνων (Ozaki and Nakagawara, 2011).
5. IFNs τύπου Ι και COVID-19
Οι IFN τύπου I διαδραματίζουν ουσιαστικό ρόλο στην καταπολέμηση των ιογενών λοιμώξεων και οι ανεπάρκειες στη σηματοδότηση των IFN τύπου I έχουν συσχετιστεί με κακές εκβάσεις από την COVID-19 σε πολλές μελέτες.
Οι περιπτώσεις αυτές συχνά συνδέονται με αυτοαντισώματα έναντι των IFN τύπου Ι. Όπως εξετάζεται κατωτέρω, οι IFN τύπου Ι έχουν χρησιμοποιηθεί με κάποια επιτυχία στη θεραπεία της βαριάς μορφής COVID-19, ιδίως εάν χορηγηθούν πολύ νωρίς στη διαδικασία της νόσου.
Εάν, όπως υποστηρίζεται ανωτέρω, τα εμβόλια mRNA παρεμβαίνουν στη σηματοδότηση της IFN τύπου Ι, αυτό θα μπορούσε να οδηγήσει σε αυξημένη ευαισθησία στο COVID-19 κατά τις δύο εβδομάδες μετά το πρώτο εμβόλιο, πριν ξεκινήσει η αντισωματική απάντηση.
Τα κύτταρα που έχουν μολυνθεί με έναν ιό ανιχνεύουν την παρουσία της αντιγραφής του ιού μέσω ενός αριθμού υποδοχέων αναγνώρισης προτύπων (PRRs), οι οποίοι χρησιμεύουν ως φρουροί που αντιλαμβάνονται τις ανώμαλες δομές RNA που συχνά σχηματίζονται κατά την αντιγραφή του ιού. Αυτοί οι υποδοχείς ανταποκρίνονται με ολιγομερισμό και στη συνέχεια με επαγωγή των IFN τύπου Ι, ρυθμίζοντας τελικά έναν μεγάλο αριθμό πρωτεϊνών που εμπλέκονται στην καταστολή του ιικού πολλαπλασιασμού (Janeway and Medzhitov, 2002).
Μια μελέτη πολλαπλών συγγραφέων από ερευνητές στο Παρίσι της Γαλλίας, η οποία περιελάμβανε μια ομάδα 50 ασθενών με COVID-19 με διαφορετικό βαθμό βαρύτητας της νόσου, αποκάλυψε ότι οι ασθενείς με σοβαρή νόσο χαρακτηρίζονταν από μια ιδιαίτερα μειωμένη απόκριση IFN τύπου Ι (Hadjadj et al., 2020). Αυτοί οι ασθενείς δεν είχαν ουσιαστικά καθόλου IFN-β και χαμηλή παραγωγή και δραστηριότητα IFN-α.
Αυτό σχετιζόταν με ένα επίμονο ιικό φορτίο στο αίμα και μια επιδεινωμένη φλεγμονώδη απόκριση, η οποία χαρακτηριζόταν από υψηλά επίπεδα του παράγοντα νέκρωσης όγκων α (TNF-α) και του Il-6. Οι συγγραφείς πρότειναν τη θεραπεία με IFN τύπου Ι ως πιθανή θεραπευτική επιλογή. Μια δημοσίευση από διάφορους ερευνητές στις Ηνωμένες Πολιτείες εντόπισε επίσης μια μοναδική και ακατάλληλη φλεγμονώδη απόκριση σε ασθενείς με σοβαρή COVID-19, η οποία χαρακτηρίζεται από χαμηλά επίπεδα τόσο της IFN τύπου I όσο και της IFN τύπου III μαζί με αυξημένες χημειοκίνες και αυξημένη έκφραση της Il-6 (Blanco-Melo et al., 2020).
Οι IFN τύπου Ι έχουν προταθεί ακόμη και ως θεραπευτική επιλογή για τη βαριά COVID-19. Σε ένα μοντέλο χάμστερ, οι ερευνητές εξέθεσαν χάμστερ σε SARS-CoV-2 και προκάλεσαν φλεγμονώδη απόκριση στους πνεύμονες και συστηματική φλεγμονή στους απομακρυσμένους ιστούς.
Διαπίστωσαν ότι η ενδορινική χορήγηση ανασυνδυασμένης IFN-α είχε ως αποτέλεσμα τη μείωση του ιικού φορτίου και την ανακούφιση των συμπτωμάτων (Hoagland et al., 2021). Μια αναδρομική μελέτη κοόρτης σε 446 ασθενείς με COVID-19 προσδιόρισε ότι η πρώιμη χορήγηση IFN-α2b συσχετίστηκε με μειωμένη ενδονοσοκομειακή θνησιμότητα. Ωστόσο, η καθυστερημένη θεραπεία με IFN αύξησε τη θνησιμότητα και καθυστέρησε την ανάρρωση, αποκαλύπτοντας ότι η έγκαιρη χορήγηση της θεραπείας με ιντερφερόνη είναι απαραίτητη για μια ευνοϊκή ανταπόκριση (Wang et al., 2020a).
Ένας εκπληκτικός αριθμός ατόμων έχει εξουδετερωτικά αυτοαντισώματα έναντι των IFN τύπου Ι, αν και η υποκείμενη αιτιολογία αυτού του φαινομένου δεν είναι κατανοητή. Μια μελέτη που χρησιμοποίησε διαχρονικό προφίλ πάνω από 600.000 μονοπύρηνων κυττάρων περιφερικού αίματος και αλληλουχία μεταγραφών από 54 ασθενείς με COVID-19 και 26 άτομα ελέγχου διαπίστωσε αξιοσημείωτη έλλειψη γονιδιακών αποκρίσεων διεγερμένων από τις IFN τύπου Ι σε μυελοειδή κύτταρα ασθενών με κρίσιμη νόσο (van der Wijst et al., 2021).
Εξουδετερωτικά αυτοαντισώματα έναντι των IFN τύπου Ι βρέθηκαν στο 19% των ασθενών με κρίσιμη νόσο, στο 6% των ασθενών με σοβαρή νόσο και στο 0% των ασθενών με μέτρια νόσο. Μια άλλη μελέτη με έδρα τη Μαδρίτη της Ισπανίας αποκάλυψε ότι το 10% των ασθενών με σοβαρή νόσο COVID-19 είχαν αυτοάνοσα αντισώματα έναντι των IFN τύπου Ι (Troya et al., 2021). Μια μελέτη με πολλούς συγγραφείς που εδρεύει στη Γαλλία διαπίστωσε ότι η θνησιμότητα από COVID-19 ήταν σημαντικά συχνότερη σε ασθενείς με εξουδετερωτικά αυτοαντισώματα έναντι της ιντερφερόνης τύπου Ι από εκείνους που δεν είχαν εξουδετερωτικά αντισώματα (55% έναντι 23%) (Chauvineau – Grenier et al., 2022).
Τέλος, οι Stertz και Hale (2021) σημειώνουν ότι, είτε οφείλεται σε αυτοαντισώματα είτε ίσως σε πολυμορφισμούς απώλειας λειτουργίας που σχετίζονται με γονίδια του συστήματος της ιντερφερόνης, οι ανεπάρκειες στην παραγωγή ιντερφερόνης σχετίζονται με το 15% όλων των απειλητικών για τη ζωή περιπτώσεων COVID-19.
6. Οι στρατηγικές μεθυλίωσης για την κυτταρική διατήρηση παραλείπονται γενικά από τα mRNA του εμβολίου;
Η μεθυλίωση των mRNA έχει επινοηθεί εξελικτικά για τον έλεγχο της μετάφρασης των μεταγράφων και, επομένως, της έκφρασης των γονιδίων μέσω ενός πολύπλοκου καταιγισμού πρωτεϊνών μεθυλιωτών (writers), απομεθυλιωτών (eraser) και αναγνωστών. Η μεθυλίωση της αδενοσίνης είναι η πιο άφθονη επιμεταγραφική τροποποίηση του mRNA και λαμβάνει χώρα σε πολλαπλές θέσεις σε όλο το μόριο του mRNA (Zaccara et al., 2019).
Μια βασική μεθυλίωση της αδενοσίνης “N6-μεθυλαδενοσίνη (m6A)” ειδικά στο 5′ UTR των mRNAs ρυθμίζει τη φυσιολογία των φυσιολογικών κυττάρων, τη φλεγμονώδη απόκριση και την εξέλιξη του καρκίνου. Ο ρόλος και οι μηχανισμοί της m6A στις ανθρώπινες ασθένειες είναι εκτεταμένοι και καλύπτονται άριστα σε άλλες εκτενείς ανασκοπήσεις (Yang et al., 2020 – Knuckles and Bühler, 2018). Πρωταρχικά, ο μοριακός εμβολιασμός SARS-CoV-2 προκαλεί συνθήκες κυτταρικού στρες, όπως περιγράφεται από την αυξημένη σηματοδότηση NF-κB μετά τον εμβολιασμό (Liu et al., 2021 – Koo et al., 2010).
Υπό συνθήκες κυτταρικού στρες, οι οποίες μπορεί να προκληθούν από μια ιογενή λοίμωξη ή από καταστάσεις ασθενειών όπως ο καρκίνος, το m6A μεσολαβεί ώστε τα mRNAs να υποστούν μετάφραση κατά προτίμηση με τρόπο που δεν εξαρτάται από το κάλυμμα (Meyer et al., 2015).
Όπως συζητήθηκε προηγουμένως, αυτό είναι αντίθετο με τον αντίκτυπο του εμβολιασμού των mRNA SARS-CoV-2, ο οποίος οδηγεί τα κύτταρα προς μια cap-εξαρτώμενη μετάφραση. Επιπλέον, υπό διαφοροποιημένες συνθήκες κυτταρικού στρες, υπάρχει μια συντριπτική επαγωγή της προσθήκης m6A σε όλο το μεταγραφικό σώμα, η οποία προκαλεί αυξημένο αριθμό mRNAs που διαθέτουν 5′UTRs εμπλουτισμένα με m6A (Meyer et al., 2015).
Ο ευκαρυωτικός παράγοντας έναρξης της μετάφρασης 4E (eIF4E) είναι η αρχική πρωτεΐνη πρόσδεσης του καλύμματος του mRNA που κατευθύνει τα ριβοσώματα στη δομή του καλύμματος των mRNA, προκειμένου να ξεκινήσει η μετάφραση σε πρωτεΐνη. Η εξάρτηση από την εξαρτώμενη από το καπάκι μετάφραση των mRNA εμβολίων θα καταναλώσει ένα πλεόνασμα διαθεσιμότητας του eIF4E που απαιτείται για τη μετάφραση ενός αφύσικα υψηλού αριθμού συνθετικών mRNA.
Ωστόσο, η ανεξάρτητη από το κάλυμμα μετάφραση πραγματοποιείται χωρίς να απαιτείται η δέσμευση του eIF4E στον eIF4F. Ο ανταγωνισμός για τα ριβοσώματα θα μετατοπιστεί προς την κατεύθυνση της ανεξάρτητης από το καπάκι μετάφρασης των μεταγράφων, καθώς τα mRNA που υφίστανται ανεξάρτητη από το κάλλυμα μετάφραση είναι εξοπλισμένα, εκτός από τις εσωτερικές θέσεις εισόδου στο ριβόσωμα (IRES), με ειδικά μοτίβα πρόσδεσης που προσδένονται σε παράγοντες που προσλαμβάνουν ενεργά τα mRNA στα ριβοσώματα cap-independent translational enhancers (CITEs) (Shatsky et al., 2018).
Επιπλέον, αυτό σημαίνει επίσης ότι ο eIF4E, ο οποίος είναι ένας ισχυρός ρυθμιστής ογκογονιδίων και ρυθμιστής του κυτταρικού πολλαπλασιασμού, θα διατηρήσει τις δραστηριότητές του μέσω αυτού του ανταγωνισμού για αφύσικα παρατεταμένο χρονικό διάστημα, προσπαθώντας να εξισορροπήσει τον ανταγωνισμό μεταξύ των mRNA με ισχυρό κάλυμμα στα εμβόλια και των mRNA που περιέχουν IRES (Kyriakopoulos and McCullough, 2021 – Svitkin et al., 2005).
Αυτού του είδους οι συνθήκες έχουν ως αποτέλεσμα τη δυσλειτουργία των συν-μεταγραφικών τροποποιήσεων του mRNA m6A και συνδέονται σοβαρά με τη μοριακή εξέλιξη διαφόρων καρκίνων (Han and Choe, 2020), καθώς και με τη δημιουργία προδιαθεσικών συνθηκών για επακόλουθες ιογενείς λοιμώξεις (Svitkin et al., 2005).
Στη συνέχεια εξετάζουμε τον αντίκτυπο της προερχόμενης από τον εμβολιασμό mRNA γλυκοπρωτεΐνης αιχμής SARS-CoV-2 στο κυτταρικό σύστημα IFN μέσω μαζικής παραγωγής εξωσωμάτων.
7. Εξωσώματα και MicroRNAs
Ένα σημαντικό δίκτυο επικοινωνίας μεταξύ των κυττάρων αποτελείται από εξωκυτταρικά κυστίδια (EVs) που απελευθερώνονται συνεχώς από ένα κύτταρο και αργότερα προσλαμβάνονται από ένα άλλο κύτταρο, το οποίο μπορεί να βρίσκεται σε ένα απομακρυσμένο όργανο.
Τα μικρά κυστίδια γνωστά ως εξωσώματα, που σχηματίζονται μέσα στα ενδοσώματα, είναι παρόμοια σε μέγεθος με τους ιούς και απελευθερώνονται μέσω εξωκυττάρωσης στον εξωκυττάριο χώρο για να κυκλοφορήσουν στη συνέχεια σε όλο το σώμα (Yoshikawa et al., 2019).
Τα εξωσώματα μπορούν να μεταφέρουν μια ποικίλη συλλογή βιολογικά ενεργών μορίων, συμπεριλαμβανομένων mRNA, microRNAs (miRNAs), πρωτεϊνών και λιπιδίων (Ratajczak and Ratajczak, 2016). Κατά τη διάρκεια μιας ιογενούς λοίμωξης, τα μολυσμένα κύτταρα εκκρίνουν μεγάλες ποσότητες εξωσωμάτων που λειτουργούν ως δίκτυο επικοινωνίας μεταξύ των κυττάρων για την ενορχήστρωση της απόκρισης στη λοίμωξη (Chahar et al., 2015).
Σε μια συλλογική προσπάθεια μιας ομάδας ερευνητών από την Αριζόνα και το Κονέκτικατ, διαπιστώθηκε ότι τα άτομα που εμβολιάστηκαν με τα εμβόλια mRNA απέκτησαν κυκλοφορούντα εξωσώματα που περιείχαν τη γλυκοπρωτεΐνη SARS-CoV-2 spike από την 14η ημέρα μετά τον εμβολιασμό (Bansal et al., 2021). Διαπίστωσαν επίσης ότι δεν υπήρχαν κυκλοφορούντα αντισώματα έναντι της γλυκοπρωτεΐνης spike δεκατέσσερις ημέρες μετά το πρώτο εμβόλιο.
Μετά το δεύτερο εμβόλιο, ωστόσο, ο αριθμός των κυκλοφορούντων εξωσωμάτων που περιείχαν γλυκοπρωτεΐνη spike αυξήθηκε έως και κατά 12 φορές. Επιπλέον, τα αντισώματα εμφανίστηκαν για πρώτη φορά την 14η ημέρα. Τα εξωσώματα παρουσίαζαν στην επιφάνειά τους γλυκοπρωτεΐνη spike, η οποία, όπως υποστήριξαν οι συγγραφείς, διευκόλυνε την παραγωγή αντισωμάτων.
Όταν τα ποντίκια εκτέθηκαν σε εξωσώματα που προέρχονταν από εμβολιασμένους ανθρώπους, ανέπτυξαν αντισώματα έναντι της γλυκοπρωτεΐνης spike. Είναι ενδιαφέρον ότι, μετά τη μέγιστη έκφραση, ο αριθμός των κυκλοφορούντων εξωσωμάτων που περιείχαν γλυκοπρωτεΐνη spike μειώθηκε με την πάροδο του χρόνου, σε συνδυασμό με τη μείωση του επιπέδου των αντισωμάτων έναντι της γλυκοπρωτεΐνης spike.
Τα εξωσώματα υπάρχουν ως μέρος του μηχανισμού διάσπασης του mRNA σε στενή συσχέτιση υπό συνθήκες στρες με τα κοκκία στρες (SGs) και τα σωμάτια P (PBs) (Decker and Parker, 2012– Kothandan et al., 2020). Υπό συνθήκες μετάφρασης που προκαλείται από εμβόλιο-mRNA, η οποία θα μπορούσε να ονομαστεί “υπερβολική εξάρτηση από την εξαρτώμενη από το στέλεχος μετάφραση”, υπάρχει προφανής αντίσταση στην προώθηση και τη συναρμολόγηση του μεγάλου συμπλόκου αποκάλυψης (Kyriakopoulos and McCullough, 2021) και, επομένως, αντίσταση στις φυσιολογικές διαδικασίες αποσύνθεσης του mRNA (Decker and Parker, 2012).
Αυτό θα σήμαινε ότι παραλείπεται η τύχη συγκεκριμένων συνθετικών mRNA, η οποία διαφορετικά θα καθοριζόταν από την κοινή κυτταρική στρατηγική για τον κύκλο εργασιών του mRNA που περιλαμβάνει τις αγγελιοφόρες ριβονουκλεϊνικές πρωτεΐνες (mRNPs) (Borbolis and Syntichaki, 2015).
Επιπλέον, υπό συνθήκες υπερβολικής εξάρτησης από την εξαρτώμενη από το στέλεχος μετάφραση από τα συνθετικά mRNA στα εμβόλια SARS-CoV-2 (Kyriakopoulos and McCullough, 2021), πολλά εγγενή mRNA που κατέχουν στη δομή τους σημαντικές IRES και ειδικές μεθυλιώσεις (m6A) θα επιλέξουν ευνοϊκά την ανεξάρτητη από το στέλεχος μετάφραση, η οποία συνδέεται στενά με μηχανισμούς ελέγχου της ποιότητας της αποσύνθεσης του mRNA (Han and Choe, 2020). Υπό αυτή την έννοια, τα σημαντικά αποαδενυλιωμένα προϊόντα mRNA καθώς και τα προϊόντα που προέρχονται από το μεταβολισμό του mRNA (αποσύνθεση) συνδέονται άμεσα με τα φορτία των εξωσωμάτων (Borbolis and Syntichaki, 2015).
Ένα παράδειγμα σχέσης εξάρτησης από την εξαρτώμενη από το στέλεχος μετάφραση περιγράφεται στην οξεία λεμφοβλαστική λευχαιμία των Τ-κυττάρων (T-ALL). Λόγω της υπερλειτουργίας του μηχανικού στόχου της ραπαμυκίνης C (mTORC)-1 στην T-ALL, τα κύτταρα οδηγούνται πλήρως προς την εξαρτώμενη από το καπάκι μετάφραση (Girardi and De Keersmaecker, 2015). Μια ανάλογη κατάσταση περιγράφεται από τους Kyriakopoulos και McCullough (2021).
Ακόμα και σε αυτή την εξαιρετικά επιθετική καρκινική κατάσταση, κατά την αναστολή της εξαρτώμενης από το κάλυμμα μετάφρασης στα κύτταρα T-ALL, παρατηρείται μια ταχεία επιστροφή στην ανεξάρτητη από το κάλυμμα μετάφραση (Girardi and De Keersmaecker, 2015). Παρομοίως, μια μόλυνση από τον ιό picornavirus (Jang et al., 1990) οδηγεί τα κύτταρα σε cap-ανεξάρτητη μετάφραση λόγω της αναστολής των συστατικών του συμπλόκου eIF4F και του πλουραλισμού των IRES στο ιικό RNA.
Στον άνθρωπο, υπάρχει πληθώρα κυρίως ασυμπτωματικών λοιμώξεων από picornavirus όπως ο ιός Safford με ορολογικό επιπολασμό άνω του 90% σε μικρά παιδιά και ενήλικες (Zoll et al., 2009). Σε κάθε περίπτωση, είτε πρόκειται για ένα αποπτωτικό συμβάν λόγω μιας κατάστασης που μοιάζει με στρες (Rusk, 2008) είτε για ένα καρκινωματώδες αποτέλεσμα που οφείλεται σε mRNA-cap (De Paolis et al., 2021), τα επίπεδα των miRNA θα είναι αυξημένα λόγω της αυξημένης επιτρωματικής λειτουργίας και της ενισχυμένης αποσύνθεσης του mRNA. Λόγω της υψηλής απαίτησης για γονιδιακή έκφραση, υψηλά επίπεδα ορισμένων miRNA αναμένεται να περιέχονται στα εξωσώματα μέσω των σωμάτων P (Yu et al., 2016).
Επίσης, υπό συνθήκες συντριπτικής παραγωγής της γλυκοπρωτεΐνης ακίδας SARS-CoV-2 λόγω του μοριακού εμβολιασμού SARS-CoV-2, θα ήταν φυσικά αναμενόμενο ότι ένα σημαντικό ποσοστό των υπερβολικά άφθονων ενδοκυτταρικών γλυκοπρωτεϊνών ακίδας θα εξάγεται επίσης μέσω φορτίων εξωσωμάτων (Wei et al., 2021).
Οι Mishra και Banerjea (2021) διερεύνησαν τον ρόλο των εξωσωμάτων στην κυτταρική απόκριση των διαμολυσμένων με spike SARS-CoV-2 κυττάρων. Στην περίληψη έγραψαν:
” Υποστηρίζουμε ότι το γονιδιακό προϊόν του SARS-CoV-2, Spike, είναι σε θέση να τροποποιεί το εξωσωματικό φορτίο του ξενιστή, το οποίο μεταφέρεται σε απομακρυσμένους μη μολυσμένους ιστούς και όργανα και μπορεί να ξεκινήσει έναν καταστροφικό ανοσολογικό καταιγισμό εντός του Κεντρικού Νευρικού Συστήματος (ΚΝΣ)”.
Τα πειράματά τους περιλάμβαναν την καλλιέργεια ανθρώπινων κυττάρων HEK293T σε καλλιέργεια και την έκθεσή τους σε πλασμίδια του γονιδίου spike του SARS-CoV-2, τα οποία προκάλεσαν τη σύνθεση της γλυκοπρωτεΐνης spike εντός των κυττάρων. Διαπίστωσαν πειραματικά ότι τα κύτταρα αυτά απελευθέρωσαν άφθονα εξωσώματα που φιλοξενούσαν τη γλυκοπρωτεΐνη spike μαζί με συγκεκριμένα microRNAs.
Στη συνέχεια συνέλεξαν τα εξωσώματα και τα μετέφεραν σε κυτταρική καλλιέργεια ανθρώπινης μικρογλοίας (τα κύτταρα του ανοσοποιητικού συστήματος που κατοικούν στον εγκέφαλο). Έδειξαν ότι η μικρογλοία προσλάμβανε εύκολα τα εξωσώματα και ανταποκρίθηκε στα microRNAs ξεκινώντας μια οξεία φλεγμονώδη αντίδραση.
Ο ρόλος της μικρογλοίας στην πρόκληση νευροφλεγμονής σε διάφορες ιογενείς ασθένειες, όπως ο ιός της ανθρώπινης ανοσοανεπάρκειας (HIV), ο ιός της ιαπωνικής εγκεφαλίτιδας (JEV) και ο δάγκειος πυρετός, είναι καλά τεκμηριωμένος. Πρότειναν ότι η επικοινωνία κυττάρων-κυττάρων σε μεγάλες αποστάσεις μέσω εξωσωμάτων θα μπορούσε να είναι ο μηχανισμός με τον οποίο τα νευρολογικά συμπτώματα εκδηλώνονται σε σοβαρές περιπτώσεις COVID-19.
Σε περαιτέρω διερεύνηση, οι συγγραφείς εντόπισαν δύο microRNAs που υπήρχαν σε υψηλές συγκεντρώσεις στα εξωσώματα: miR-148a και miR-590. Πρότειναν έναν ειδικό μηχανισμό με τον οποίο αυτά τα δύο microRNAs θα διέκοπταν ειδικά τη σηματοδότηση της ιντερφερόνης τύπου Ι, μέσω της καταστολής δύο κρίσιμων πρωτεϊνών που ελέγχουν το μονοπάτι: της ειδικής πεπτιδάσης της ουβικουιτίνης 33 (USP33) και του IRF9. Τα φωσφορυλιωμένα ετεροδιμερή STAT1 και STAT2 απαιτούν τον IRF9 προκειμένου να δεσμεύσουν τα στοιχεία απόκρισης που διεγείρονται από την IFN και, επομένως, ο IRF9 διαδραματίζει ουσιαστικό ρόλο στη σηματοδοτική απόκριση.
Οι συγγραφείς έδειξαν πειραματικά ότι η μικρογλοία που εκτέθηκε στα εξωσώματα που εξήχθησαν από την καλλιέργεια HEK293 είχε 50% μείωση της κυτταρικής έκφρασης του USP33 και 60% μείωση του IRF9. Διαπίστωσαν περαιτέρω ότι ο miR-148a μπλοκάρει ειδικά το USP33 και ο miR-590 μπλοκάρει ειδικά τον IRF9. Ο USP33 απομακρύνει την ουβικουιτίνη από τον IRF9 και με τον τρόπο αυτό τον προστατεύει από την αποικοδόμηση. Έτσι, τα δύο microRNA συνωμοτούν από κοινού για να παρεμβαίνουν στον IRF9, μπλοκάροντας έτσι την απόκριση του υποδοχέα στις ιντερφερόνες τύπου Ι.
Μια μελέτη των de Gonzalo-Calvo et al. (2021) εξέτασε το προφίλ των microRNA στο αίμα των ασθενών με COVID-19 και την ποσοτική τους διακύμανση με βάση τη σοβαρότητα της νόσου. Διαπιστώθηκε ότι πολλαπλά miRNAs ρυθμίζονται προς τα πάνω και προς τα κάτω. Μεταξύ αυτών ήταν το miR-148a-3p, ο πρόδρομος του οδηγού σκέλους του miR-148a.
Ωστόσο, το ίδιο το miR-148a δεν ήταν μεταξύ των microRNAs που καταγράφηκαν ως υπερβολικά ή ανεπαρκή στη μελέτη τους, όπως και το miR-590. Από αυτά τα ευρήματα φαίνεται ότι οι miR148a και miR-590 και οι φλεγμονώδεις επιδράσεις τους είναι μοναδικές στην επαγόμενη από τον εμβολιασμό παραγωγή γλυκοπρωτεϊνών αιχμής SARS-CoV-2.
Μελέτες με ιχνηθέτες έχουν δείξει ότι, μετά την έγχυση στον μυ του βραχίονα, το mRNA στα εμβόλια mRNA μεταφέρεται στο λεμφικό σύστημα από τα κύτταρα του ανοσοποιητικού συστήματος και τελικά συσσωρεύεται στον σπλήνα σε υψηλές συγκεντρώσεις (Bahl et al., 2017).
Άλλες μελέτες έχουν δείξει ότι τα στρεσαρισμένα ανοσοκύτταρα στα βλαστικά κέντρα του σπλήνα απελευθερώνουν μεγάλες ποσότητες εξωσωμάτων που ταξιδεύουν στους πυρήνες του εγκεφαλικού στελέχους κατά μήκος του πνευμονογαστρικού νεύρου (όπως εξετάζεται στο Seneff and Nigh (2021)). Το πνευμονογαστρικό νεύρο είναι το 10ο κρανιακό νεύρο και εισέρχεται στο στέλεχος του εγκεφάλου κοντά στο λάρυγγα. Το ανώτερο και το επαναλαμβανόμενο λαρυγγικό νεύρο είναι κλάδοι του πνευμονογαστρικού που νευρώνουν δομές που εμπλέκονται στην κατάποση και την ομιλία.
Οι βλάβες σε αυτά τα νεύρα προκαλούν παράλυση των φωνητικών χορδών που συνδέεται με δυσκολία στην κατάποση (δυσφαγία) δυσκολία στην ομιλία (δυσφωνία) και/ή δύσπνοια (δύσπνοια) (Gould et al., 2019– Erman et al., 2009). Θα επανέλθουμε σε αυτές τις συγκεκριμένες παθολογίες στην ανασκόπηση των δεδομένων VAERS που ακολουθεί.
Τα κύτταρα HEK293 προήλθαν αρχικά από καλλιέργειες που ελήφθησαν από το νεφρό ενός ανθρώπινου εμβρύου πριν από αρκετές δεκαετίες και αθανατίστηκαν μέσω μόλυνσης με DNA αδενοϊού. Παρόλο που εξήχθησαν από το νεφρό, τα κύτταρα δείχνουν μέσω του προφίλ έκφρασης των πρωτεϊνών τους ότι είναι πιθανό να είναι νευρωνικής προέλευσης (Shaw et al., 2002).
Αυτό υποδηλώνει ότι οι νευρώνες του πνευμονογαστρικού νεύρου θα ανταποκρίνονταν παρόμοια στη γλυκοπρωτεΐνη ακίδας SARS-CoV-2. Έτσι, τα διαθέσιμα στοιχεία υποδηλώνουν έντονα ότι η ενδογενώς παραγόμενη γλυκοπρωτεΐνη SARS-CoV-2 spike δημιουργεί ένα διαφορετικό προφίλ microRNA από ό,τι η φυσική μόλυνση με SARS-CoV-2, και οι διαφορές αυτές συνεπάγονται ένα δυνητικά ευρύ φάσμα επιβλαβών επιδράσεων.
Ένα κεντρικό σημείο της ανάλυσής μας παρακάτω είναι η σημαντική διάκριση μεταξύ της επίδρασης του εμβολιασμού και της φυσικής λοίμωξης στην IFN τύπου Ι. Ενώ ο εμβολιασμός καταστέλλει ενεργά την παραγωγή της, η φυσική λοίμωξη προάγει την παραγωγή IFN τύπου Ι πολύ νωρίς στον κύκλο της νόσου.
Τα άτομα με προϋπάρχουσες παθήσεις συχνά παρουσιάζουν μειωμένη σηματοδότηση της IFN τύπου Ι, η οποία οδηγεί σε πιο σοβαρή, κρίσιμη, ακόμη και θανατηφόρα COVID-19. Εάν η εξασθένιση που προκαλείται από το εμβόλιο διατηρείται καθώς τα επίπεδα αντισωμάτων μειώνονται με την πάροδο του χρόνου, αυτό θα μπορούσε να οδηγήσει σε μια κατάσταση όπου το εμβόλιο προκαλεί πιο σοβαρή εκδήλωση της νόσου από ό,τι θα συνέβαινε αν δεν υπήρχε το εμβόλιο.
Μια άλλη αναμενόμενη συνέπεια της καταστολής της IFN τύπου Ι θα ήταν η επανενεργοποίηση προϋπαρχουσών, χρόνιων ιογενών λοιμώξεων, όπως περιγράφεται στην Ενότητα 9.
8. Διαταραγμένη επιδιόρθωση του DNA και προσαρμοστική ανοσία
Το ανοσοποιητικό σύστημα και το σύστημα επιδιόρθωσης του DNA είναι τα δύο πρωταρχικά συστήματα στα οποία βασίζονται οι ανώτεροι οργανισμοί για την άμυνα έναντι διαφόρων απειλών και μοιράζονται κοινά στοιχεία.
Η απώλεια της λειτουργίας βασικών πρωτεϊνών επιδιόρθωσης του DNA οδηγεί σε ελαττώματα στην επιδιόρθωση που αναστέλλουν την παραγωγή λειτουργικών Β- και Τ-κυττάρων, με αποτέλεσμα την ανοσοανεπάρκεια. Η επιδιόρθωση της μη ομόλογης ένωσης άκρων (NHEJ) διαδραματίζει κρίσιμο ρόλο στον ειδικό για τα λεμφοκύτταρα ανασυνδυασμό V(D)J, ο οποίος είναι απαραίτητος για την παραγωγή του εξαιρετικά ποικίλου ρεπερτορίου αντισωμάτων των Β-κυττάρων ως απάντηση στην έκθεση σε αντιγόνο (Jiang and Mei, 2021). Η διαταραγμένη επιδιόρθωση του DNA αποτελεί επίσης μια άμεση οδό προς τον καρκίνο.
Σε μια δημοσίευση των Liu κ.ά., το 2021, παρακολουθήθηκαν διάφορες παράμετροι που σχετίζονται με την ανοσολογική λειτουργία σε μια ομάδα ασθενών με τη διενέργεια αλληλουχίας mRNA ενός κυττάρου σε μονοπύρηνα μονοπύρηνα κύτταρα περιφερικού αίματος (PBMC) που συλλέχθηκαν από τους ασθενείς πριν και 28 ημέρες μετά την πρώτη ένεση ενός εμβολίου COVID-19 που βασίζεται σε μια εξασθενημένη έκδοση του ιού (Liu κ.ά., 2021). Ενώ αυτά τα εμβόλια είναι διαφορετικά από τα εμβόλια mRNA, λειτουργούν επίσης με την έγχυση του περιεχομένου του εμβολίου στον δελτοειδή μυ, παρακάμπτοντας τους βλεννογόνους και αγγειακούς φραγμούς.
Οι συγγραφείς διαπίστωσαν συνεπή μεταβολή της γονιδιακής έκφρασης μετά τον εμβολιασμό σε πολλούς διαφορετικούς τύπους κυττάρων του ανοσοποιητικού συστήματος. Οι παρατηρούμενες αυξήσεις στη σηματοδότηση NF-κΒ και οι μειωμένες αποκρίσεις IFN τύπου Ι επιβεβαιώθηκαν περαιτέρω με βιολογικές δοκιμασίες.
Σε συμφωνία με άλλες μελέτες, διαπίστωσαν ότι οι STAT2 και IRF7 ήταν σημαντικά υπορυθμισμένοι 28 ημέρες μετά τον εμβολιασμό, ενδεικτικό των μειωμένων αποκρίσεων τύπου Ι IFN. Έγραψαν: “Συνολικά, αυτά τα δεδομένα υποδηλώνουν ότι μετά τον εμβολιασμό, τουλάχιστον μέχρι την 28η ημέρα, εκτός από τη δημιουργία εξουδετερωτικών αντισωμάτων, τα ανοσοποιητικά συστήματα των ανθρώπων, συμπεριλαμβανομένων των λεμφοκυττάρων και των μονοκυττάρων, βρίσκονταν ίσως σε πιο ευάλωτη κατάσταση”. (Liu et al., 2021).
Οι εν λόγω συγγραφείς εντόπισαν επίσης ανησυχητικές αλλαγές στην έκφραση γονιδίων που υποδηλώνουν μειωμένη ικανότητα επιδιόρθωσης του DNA. Έως και το 60% της συνολικής μεταγραφικής δραστηριότητας στα αναπτυσσόμενα κύτταρα περιλαμβάνει τη μεταγραφή του ριβοσωματικού DNA (rDNA) για την παραγωγή ριβοσωματικού RNA (rRNA). Το ένζυμο που μεταγράφει το ριβοσωμικό DNA σε RNA είναι η RNA πολυμεράση Ι (Pol I). Η Pol I παρακολουθεί επίσης την ακεραιότητα του rDNA και επηρεάζει την επιβίωση των κυττάρων (Kakarougkas et al., 2013). Κατά τη διάρκεια της μεταγραφής, οι RNA πολυμεράσες (RNAP) σαρώνουν ενεργά το DNA για να βρουν ογκώδεις βλάβες (σπασίματα διπλής έλικας) και να προκαλέσουν την επιδιόρθωσή τους. Στα αναπτυσσόμενα ευκαρυωτικά κύτταρα, το μεγαλύτερο μέρος της μεταγραφής περιλαμβάνει τη σύνθεση του ριβοσωματικού RNA από την Pol I. Έτσι, η Pol I προάγει την επιβίωση μετά από βλάβη του DNA (Kakarougkas et al., 2013). Πολλά από τα γονίδια με μειωμένη ρύθμιση που εντοπίστηκαν από τους Liu κ.ά. (2021) συνδέονταν με τον κυτταρικό κύκλο, τη διατήρηση των τελομερών και τόσο με το άνοιγμα του υποκινητή όσο και με τη μεταγραφή του Pol I, ενδεικτικά των διαταραγμένων διαδικασιών επιδιόρθωσης του DNA.
Ένα από τα σύνολα γονιδίων που καταστέλλονταν οφειλόταν στην “εναπόθεση νέων νουκλεοσωμάτων CENPA [centromere protein A] που περιέχουν νουκλεοσώματα στο κεντρομερίδιο”. Η νεοσυντιθέμενη CENPA εναποτίθεται σε νουκλεοσώματα στο κεντρομερίδιο κατά την όψιμη τελόφαση/πρώιμη φάση G1 του κυτταρικού κύκλου. Αυτό υποδεικνύει τη διακοπή του κυτταρικού κύκλου στη φάση G1 ως χαρακτηριστικό γνώρισμα της απόκρισης στο αδρανοποιημένο εμβόλιο SARS-CoV-2. Η ακινητοποίηση των πολυδύναμων εμβρυϊκών βλαστικών κυττάρων στη φάση G1 (πριν από την έναρξη της αντιγραφής) θα είχε ως αποτέλεσμα τη μειωμένη αυτοανανέωση και τη διατήρηση της πολυδυναμίας (Choi et al., 2013).
Δύο πρωτεΐνες σημείου ελέγχου που εμπλέκονται καθοριστικά στην επιδιόρθωση του DNA και την προσαρμοστική ανοσία είναι οι BRCA1 και 53BP1, οι οποίες διευκολύνουν τόσο τον ομόλογο ανασυνδυασμό (HR) όσο και τον NHEJ, τις δύο πρωταρχικές διαδικασίες επιδιόρθωσης (Zhang and Powell, 2005 – Panier and Boulton, 2014). Σε ένα in vitro πείραμα σε ανθρώπινα κύτταρα, η γλυκοπρωτεΐνη SARS-CoV-2 πλήρους μήκους spike αποδείχθηκε ειδικά ότι εισέρχεται στον πυρήνα και εμποδίζει την πρόσληψη αυτών των δύο πρωτεϊνών επιδιόρθωσης στο σημείο μιας ρήξης διπλής έλικας (Jiang and Mei, 2021).
Οι συγγραφείς συνόψισαν τα ευρήματά τους λέγοντας: “Μηχανιστικά, διαπιστώσαμε ότι η πρωτεΐνη spike εντοπίζεται στον πυρήνα και αναστέλλει την επιδιόρθωση βλαβών του DNA εμποδίζοντας την πρόσληψη των βασικών πρωτεϊνών επιδιόρθωσης του DNA BRCA1 και 53BP1 στο σημείο της βλάβης”.
Ένας άλλος μηχανισμός με τον οποίο τα εμβόλια mRNA θα μπορούσαν να παρεμβαίνουν στην επιδιόρθωση του DNA είναι μέσω του miR-148. Αυτό το microRNA έχει αποδειχθεί ότι ρυθμίζει προς τα κάτω την HR στη φάση G1 του κυτταρικού κύκλου (Choi et al., 2014). Όπως αναφέρθηκε νωρίτερα στην παρούσα μελέτη, αυτό ήταν ένα από τα δύο microRNA που βρέθηκαν στα εξωσώματα που απελευθερώθηκαν από τα ανθρώπινα κύτταρα μετά τη σύνθεση της γλυκοπρωτεΐνης ακίδας SARS-CoV-2 στα πειράματα των Mishra και Banerjea (2021).
9. Επαναδραστηριοποίηση της ανεμευλογιάς-ζωστήρα
Η σηματοδότηση του υποδοχέα IFN τύπου Ι στα CD8+ Τ κύτταρα είναι κρίσιμη για τη δημιουργία κυττάρων-εκτελεστών και κυττάρων μνήμης ως απάντηση σε μια ιογενή λοίμωξη (Kolumam et al., 2005). Τα CD8+ Τ κύτταρα μπορούν να εμποδίσουν την επανενεργοποίηση της λανθάνουσας λοίμωξης από έρπητα στους αισθητικούς νευρώνες (Liu et al., 2000). Εάν η σηματοδότηση της IFN τύπου Ι είναι εξασθενημένη, όπως συμβαίνει μετά από εμβολιασμό αλλά όχι μετά από φυσική λοίμωξη με SARS-CoV-2, η ικανότητα των CD8+ Τ κυττάρων να συγκρατούν τον έρπητα υπό έλεγχο θα ήταν επίσης εξασθενημένη. Μήπως αυτός είναι ο μηχανισμός που λειτουργεί ως απόκριση στα εμβόλια;
Ο έρπης ζωστήρας είναι μια ολοένα και πιο συχνή πάθηση που προκαλείται από την επανενεργοποίηση λανθανόντων ιών έρπητα ζωστήρα (HZV), οι οποίοι προκαλούν επίσης ανεμοβλογιά στην παιδική ηλικία. Σε μια συστηματική ανασκόπηση, οι Katsikas Triantafyllidis et al. (2021) εντόπισαν 91 περιπτώσεις έρπητα ζωστήρα που εμφανίστηκαν κατά μέσο όρο 5,8 ημέρες μετά τον εμβολιασμό με mRNA.
Αν και αναγνωρίζουν ότι η αιτιώδης συνάφεια δεν έχει ακόμη επιβεβαιωθεί, “ο έρπης ζωστήρας είναι ενδεχομένως μια κατάσταση που οι γιατροί και άλλοι επαγγελματίες του τομέα της υγειονομικής περίθαλψης μπορούν να αναμένουν να δουν σε ασθενείς που λαμβάνουν εμβόλια COVID-19” (Katsikas Triantafyllidis et al., 2021).
Σε μια επιστολή προς τον συντάκτη που δημοσιεύθηκε στις 2 Σεπτεμβρίου 2021, οι Fathy et al. (2022) ανέφεραν 672 περιπτώσεις δερματικών αντιδράσεων που πιθανώς σχετίζονταν με το εμβόλιο, συμπεριλαμβανομένων 40 περιπτώσεων έρπητα ζωστήρα και/ή επανενεργοποίησης του απλού έρπητα. Τα περιστατικά αυτά είχαν αναφερθεί στο δερματολογικό μητρώο COVID-19 της Αμερικανικής Ακαδημίας Δερματολογίας και του International League of Dermatologic Societies, το οποίο δημιουργήθηκε ειδικά για την παρακολούθηση των δερματολογικών επακόλουθων από τα εμβόλια.
Στη βιβλιογραφία υπάρχουν πολλαπλές πρόσθετες αναφορές περιπτώσεων επανενεργοποίησης του έρπητα ζωστήρα μετά τον εμβολιασμό COVID-19 (Psichogiou et al., 2021b – Iwanaga et al., 2021). Οι Lladó et al. (2021) σημείωσαν ότι 51 από τις 52 αναφορές επανενεργοποίησης λοιμώξεων έρπητα ζωστήρα συνέβησαν μετά από εμβολιασμό με mRNA. Ο ίδιος ο έρπης ζωστήρας παρεμβαίνει επίσης στη σηματοδότηση της IFN-α στα μολυσμένα κύτταρα τόσο μέσω της παρεμβολής στη φωσφορυλίωση του STAT2 όσο και μέσω της διευκόλυνσης της αποικοδόμησης του IRF9 (Verweij et al., 2015).
Αξιοσημείωτη είναι και μια πρόσθετη περίπτωση επανενεργοποίησης του ιού. Πρόκειται για μια 82χρονη γυναίκα που είχε αποκτήσει λοίμωξη από τον ιό της ηπατίτιδας C (HCV) το 2007. Σημειώθηκε έντονη αύξηση του φορτίου HCV λίγες ημέρες μετά τον εμβολιασμό με εμβόλιο mRNA της Pfizer/BioNTech, μαζί με εμφάνιση ίκτερου. Πέθανε τρεις εβδομάδες μετά τον εμβολιασμό από ηπατική ανεπάρκεια (Lensen et al., 2021).
10. Ανοσολογική θρομβοπενία
Η ανοσολογική θρομβοπενία είναι μια αυτοάνοση δυσλειτουργία, κατά την οποία το ανοσοποιητικό σύστημα επιτίθεται στα κυκλοφορούντα αιμοπετάλια. Η αυτοάνοση θρομβοπενική πορφύρα (ITP) έχει συσχετιστεί με διάφορους εμβολιασμούς, όπως ιλαρά, παρωτίτιδα, ερυθρά (MMR), ηπατίτιδα Α, ανεμοβλογιά, διφθερίτιδα, τέτανο, κοκκύτη (DPT), στοματική πολιομυελίτιδα και γρίπη (Perricone et al., 2014).
Ενώ υπάρχει ευρεία επίγνωση ότι τα εμβόλια με βάση το DNA του αδενοϊού μπορεί να προκαλέσουν ανοσοποιητική θρομβοκυτταροπενία που προκαλείται από το εμβόλιο (VITT) (Kelton et al., 2021), τα εμβόλια mRNA δεν είναι άμοιρα κινδύνου για VITT, καθώς έχουν δημοσιευτεί μελέτες περιπτώσεων που τεκμηριώνουν τέτοια περιστατικά, συμπεριλαμβανομένης της απειλητικής για τη ζωή και θανατηφόρας θρόμβωσης του εγκεφαλικού φλεβικού κόλπου (Lee et al., 2021 – Akiyama et al., 2021 – Atoui et al., 2022 – Zakaria et al., 2021).
Ο μηχανισμός πιστεύεται ότι περιλαμβάνει τη σύνδεση των αντισωμάτων VITT με τον παράγοντα 4 των αιμοπεταλίων (PF4) και τον σχηματισμό ανοσοσυμπλεγμάτων που προκαλούν ενεργοποίηση των αιμοπεταλίων. Οι επακόλουθοι καταρράκτες πήξης προκαλούν το σχηματισμό διάχυτων μικροθρόμβων στον εγκέφαλο, τους πνεύμονες, το ήπαρ, τα πόδια και αλλού, που συνδέονται με δραματική πτώση του αριθμού των αιμοπεταλίων (Kelton et al., 2021). Η αντίδραση στο εμβόλιο έχει περιγραφεί ως πολύ παρόμοια με την επαγόμενη από ηπαρίνη θρομβοπενία (HIT), με τη διαφορά ότι η χορήγηση ηπαρίνης δεν αποτελεί αξιοσημείωτο στοιχείο (Cines and Bussel, 2021).
Έχει αποδειχθεί ότι τα εμβόλια mRNA προκαλούν κυρίως ανοσολογική απόκριση ανοσοσφαιρίνης G (IgG), ενώ προκαλούνται μικρότερες ποσότητες IgA (Wisnewski et al., 2021) και ακόμη μικρότερη παραγωγή IgM (Danese et al., 2021). Η ποσότητα των αντισωμάτων IgG που παράγονται είναι συγκρίσιμη με την απόκριση που παρατηρείται σε σοβαρές περιπτώσεις COVID-19. Τα αντισώματα IgG σε σύμπλοκο με ηπαρίνη είναι αυτά που προκαλούν την HIT.
Μπορεί κανείς να υποθέσει ότι η IgG σε σύμπλοκο με τη γλυκοπρωτεΐνη αιχμής SARS-CoV-2 και την PF4 είναι το σύμπλοκο που προκαλεί VITT σε απόκριση σε εμβόλια mRNA. Έχει πράγματι αποδειχθεί πειραματικά ότι η περιοχή πρόσδεσης υποδοχέα (RBD) της πρωτεΐνης spike συνδέεται με την PF4 (Passariello et al., 2021).
Ο υποκείμενος μηχανισμός πίσω από την HIT έχει μελετηθεί επαρκώς, μεταξύ άλλων μέσω της χρήσης ανθρωποποιημένων μοντέλων ποντικών. Είναι ενδιαφέρον ότι τα ανθρώπινα αιμοπετάλια, αλλά όχι τα αιμοπετάλια ποντικιών, εκφράζουν τον υποδοχέα FcγRIIA, ο οποίος ανταποκρίνεται στα σύμπλοκα PF4/ηπαρίνης/IgG μέσω ενός καταρράκτη φωσφορυλίωσης τυροσίνης για την επαγωγή της ενεργοποίησης των αιμοπεταλίων. Κατά την ενεργοποίηση, τα αιμοπετάλια απελευθερώνουν κοκκία και παράγουν προπηκτικά μικροσωματίδια.
Προσλαμβάνουν επίσης ασβέστιο, ενεργοποιούν την πρωτεϊνική κινάση C, συσσωματώνονται σε μικροθρόμβους και δρομολογούν έναν καταρράκτη κυτταρικού θανάτου μέσω ενεργοποίησης της καλπαΐνης. Αυτά τα ενεργοποιημένα αιμοπετάλια απελευθερώνουν PF4 στον εξωκυττάριο χώρο, υποστηρίζοντας έναν φαύλο κύκλο, καθώς αυτό το πρόσθετο PF4 συνδέεται επίσης με την ηπαρίνη και το αντίσωμα IgG για να προωθήσει περαιτέρω την ενεργοποίηση των αιμοπεταλίων. Έτσι, η FcγRIIA έχει κεντρικό ρόλο στη διαδικασία της νόσου (Nevzorova et al., 2019).
Μελέτες σε ποντίκια που έχουν τροποποιηθεί ώστε να εκφράζουν τον ανθρώπινο υποδοχέα FcγRIIA έχουν δείξει ότι αυτά τα διαγονιδιακά ποντίκια είναι πολύ πιο ευαίσθητα στη θρομβοπενία από τα αντίστοιχα άγριου τύπου (McKenzie et al., 1999). Έχει προταθεί ότι τα αιμοπετάλια μπορεί να διαδραματίζουν σημαντικό ρόλο στην κάθαρση των συμπλόκων αντισώματος-αντιγόνου παγιδεύοντας το αντιγόνο σε θρόμβους και/ή μεταφέροντάς το στον σπλήνα για απομάκρυνση από τα κύτταρα του ανοσοποιητικού συστήματος. Τα αιμοπετάλια προφανώς καταναλώνονται ταχέως κατά τη διαδικασία αυτή, γεγονός που οδηγεί στη συνέχεια σε χαμηλό αριθμό αιμοπεταλίων (θρομβοπενία).
Τα αιμοπετάλια κυκλοφορούν κανονικά με μέση διάρκεια ζωής μόνο πέντε έως εννέα ημέρες, οπότε συντίθενται συνεχώς στο μυελό των οστών και καθαρίζονται στο σπλήνα. Τα αιμοπετάλια που συνδέονται με αντισώματα, μετά την ενεργοποίηση των αιμοπεταλίων μέσω των υποδοχέων Fcγ, μεταναστεύουν στον σπλήνα όπου παγιδεύονται και απομακρύνονται μέσω φαγοκυττάρωσης από τα μακροφάγα (Crow and Lazarus, 2003). Το ένα τρίτο του συνόλου των αιμοπεταλίων του σώματος βρίσκεται στον σπλήνα.
Δεδομένου ότι τα εμβόλια mRNA μεταφέρονται στον σπλήνα από ανοσοκύτταρα που προσελκύονται αρχικά στο σημείο έγχυσης στον μυ του βραχίονα, υπάρχει τεράστια ευκαιρία για την απελευθέρωση εξωσωμάτων που περιέχουν spike-γλυκοπρωτεΐνη από δενδριτικά κύτταρα στον σπλήνα που συνθέτουν spike πρωτεΐνη. Μπορεί κανείς να υποθέσει ότι η ενεργοποίηση των αιμοπεταλίων μετά τον σχηματισμό ενός συμπλόκου P4F/IgG/πρωτεΐνης spike στον σπλήνα αποτελεί μέρος του μηχανισμού που επιχειρεί να απομακρύνει την τοξική γλυκοπρωτεΐνη spike.
Αναφέραμε προηγουμένως ότι ένα από τα δύο microRNAs που εκφράζονται σε μεγάλο βαθμό στα εξωσώματα που απελευθερώνονται από ανθρώπινα κύτταρα που εκτίθενται στη γλυκοπρωτεΐνη spike SARS-CoV-2 είναι το miR-148a. Το miR-148a έχει αποδειχθεί πειραματικά ότι καταστέλλει την έκφραση μιας πρωτεΐνης που παίζει κεντρικό ρόλο στη ρύθμιση της έκφρασης της FcγRIIA στα αιμοπετάλια. Αυτή η πρωτεΐνη, που ονομάζεται T-cell ubiquitin ligand-2 (TULA-2), αναστέλλει ειδικά τη δραστηριότητα του υποδοχέα Fcγ των αιμοπεταλίων.
Ο miR-148a στοχεύει το mRNA της TULA-2 και ρυθμίζει προς τα κάτω την έκφρασή της. Έτσι, ο miR-148a, ο οποίος υπάρχει στα εξωσώματα που απελευθερώνονται από τα μακροφάγα τα οποία αναγκάζονται από το εμβόλιο να συνθέσουν τη γλυκοπρωτεΐνη αιχμής SARS-CoV-2, δρα αυξάνοντας τον κίνδυνο θρομβοπενίας ως απόκριση στα ανοσοσυμπλέγματα που σχηματίζονται από το αντιγόνο της γλυκοπρωτεΐνης αιχμής και τα αντισώματα IgG που παράγονται έναντι της γλυκοπρωτεΐνης spike.
11. PPAR-α, σουλφατίδη και ηπατική νόσος
Όπως έχουμε ήδη αναφέρει, ένα πείραμα των Mishra και Banerjea (2021) έδειξε ότι η γλυκοπρωτεΐνη SARS-CoV-2 spike επάγει την απελευθέρωση εξωσωμάτων που περιέχουν microRNAs που παρεμβαίνουν ειδικά στη σύνθεση του IRF9. Σε αυτή την ενότητα θα δείξουμε ότι μία από τις συνέπειες της καταστολής του IRF9 θα ήταν η μειωμένη σύνθεση σουλφατίδης στο ήπαρ, με τη μεσολάβηση του πυρηνικού υποδοχέα υπεροξισωματικού υποδοχέα α (PPAR-α).
Τα σουλφατίδια είναι σημαντικά σφινγογλυκολιπίδια του ορού των θηλαστικών, τα οποία συντίθενται και εκκρίνονται κυρίως από το ήπαρ (Lu et al., 2019). Είναι τα μόνα σουλφονικά σφιγγολιπίδια στον οργανισμό. Τα σουλφατίδια σχηματίζονται με μια διαδικασία δύο βημάτων που περιλαμβάνει τη μετατροπή του κεραμιδίου σε γαλακτοσερεβροσίδιο και την επακόλουθη σουλφάτευσή του.
Η σουλφατίδη εκφράζεται στην επιφάνεια των αιμοπεταλίων, των ερυθροκυττάρων και των λεμφοκυττάρων. Τα σουλφατίδια του ορού ασκούν τόσο αντιπηκτικές όσο και αντιαιμοπεταλιακές λειτουργίες. Το ένζυμο στο ήπαρ που συνθέτει τη σουλφατίδη, η σουλφοτρανσφεράση του cerebroside, έχει βρεθεί συγκεκριμένα ότι επάγεται από την ενεργοποίηση του PPAR-α σε ποντίκια (Kimura et al., 2012). Ως εκ τούτου, η μειωμένη έκφραση του PPAR-α οδηγεί σε ανεπάρκεια σουλφατίδης.
Οι συνδέτες PPAR-α παρουσιάζουν αντιφλεγμονώδη και αντι-ινωτικά αποτελέσματα, ενώ η ανεπάρκεια PPAR-α οδηγεί σε ηπατική στεάτωση, στεατοηπατίτιδα, στεατοΐνωση και καρκίνο του ήπατος (Wang et al., 2020b). Το 2019, μια ομάδα ερευνητών στην Ιαπωνία διεξήγαγε πείραμα σε ποντίκια με ελαττωματικό γονίδιο για τον PPAR-α (Lu et al., 2019). Αυτά τα ποντίκια, όταν τρέφονταν με δίαιτα υψηλής χοληστερόλης, ήταν ευαίσθητα στην υπερβολική συσσώρευση τριγλυκεριδίων και στην επιδείνωση της φλεγμονής και του οξειδωτικού στρες στο ήπαρ, μαζί με αυξημένα επίπεδα παραγόντων πήξης.
Τα ποντίκια εκδηλώθηκαν επίσης με μειωμένα επίπεδα σουλφατιδίων τόσο στο ήπαρ όσο και στον ορό. Οι συγγραφείς υπέθεσαν ότι η υπερφόρτωση με χοληστερόλη ασκεί τις τοξικές της επιδράσεις εν μέρει ενισχύοντας τη θρόμβωση, μετά από μη φυσιολογικό ηπατικό μεταβολισμό λιπιδίων και οξειδωτικό στρες. Έδειξαν ότι ο PPAR-α μπορεί να μετριάσει αυτές τις τοξικές επιδράσεις μέσω της μεταγραφικής ρύθμισης των παραγόντων πήξης και της ρύθμισης της σύνθεσης σουλφατιδίων, εκτός από τις επιδράσεις του στη βελτίωση της ηπατικής νόσου. Πρότειναν ότι θεραπείες όπως οι φιμπράτες που στοχεύουν στην ενεργοποίηση του PPAR-α θα μπορούσαν να προλάβουν την καρδιαγγειακή νόσο που προκαλείται από την υψηλή χοληστερόλη.
Μελέτες με ιχνηθέτες έχουν δείξει ότι το mRNA από τα εμβόλια mRNA μεταναστεύει κατά προτίμηση στο ήπαρ και τον σπλήνα, φθάνοντας εκεί σε υψηλότερη συγκέντρωση από ό,τι σε οποιοδήποτε άλλο όργανο (Bahl et al., 2017). Συνεπώς, υπάρχει δυνατότητα καταστολής του IRF9 στο ήπαρ από το εμβόλιο. Ο IRF9 εκφράζεται σε μεγάλο βαθμό στα ηπατοκύτταρα, όπου αλληλεπιδρά με τον PPAR-α, ενεργοποιώντας τα γονίδια-στόχους του PPAR-α. Μελέτη σε ποντίκια με έλλειψη IRF9 έδειξε ότι τα ποντίκια αυτά ανέπτυξαν στεάτωση και ηπατική αντίσταση στην ινσουλίνη όταν εκτέθηκαν σε δίαιτα υψηλής περιεκτικότητας σε λιπαρά. Αντίθετα, η υπερέκφραση του ηπατικού IRF9 μέσω αδενοϊού σε παχύσαρκα ποντίκια βελτίωσε την ευαισθησία στην ινσουλίνη και βελτίωσε τη στεάτωση και τη φλεγμονή (Wang et al., 2013).
Πολλές αναφορές περιπτώσεων στην ερευνητική βιβλιογραφία περιγράφουν ηπατική βλάβη μετά από εμβόλια mRNA (Zin Tun et al., 2021 – Dumortiera, 2022 – Mann et al., 2021). Ένας πιθανός παράγοντας που οδηγεί σε αυτά τα αποτελέσματα είναι η καταστολή του PPAR-α μέσω της μείωσης της ρύθμισης του IRF9 και, στη συνέχεια, η μειωμένη σύνθεση σουλφατίδης στο ήπαρ.
12. Σύνδρομο Guillain Barré και νευρολογικές βλάβες
Το GBS είναι μια οξεία φλεγμονώδης απομυελινωτική νευροπάθεια που συνδέεται με μακροχρόνια νοσηρότητα και σημαντικό κίνδυνο θνησιμότητας (Cr é ange, 2000). Η νόσος περιλαμβάνει μια αυτοάνοση επίθεση στα νεύρα που συνδέεται με την απελευθέρωση προφλεγμονωδών κυτταροκινών.
Το GBS συνδέεται συχνά με αυτοαντισώματα έναντι της σουλφατίδης και άλλων σφιγγολιπιδίων (Ilyas et al., 1991). Τα ενεργοποιημένα Τ-κύτταρα παράγουν κυτταροκίνες ως απόκριση στην παρουσίαση αντιγόνων από τα μακροφάγα και αυτές οι κυτταροκίνες μπορούν να προκαλέσουν την παραγωγή αυτοαντισωμάτων μέσω της εξάπλωσης των επιτόπων (Vanderlugt and Miller, 2002).
Τα αντισώματα, με τη σειρά τους, επάγουν την ενεργοποίηση του συμπληρώματος, η οποία προκαλεί απομυελίνωση και αξονική βλάβη, οδηγώντας σε σοβαρό τραυματισμό των περιφερικών νευρώνων (Kuwahara and Kusunoki, 2018). Η γλυκοπρωτεΐνη SARS-CoV-2 spike έχει αποδειχθεί ότι συνδέεται με τη θειική ηπαράνη, η οποία είναι ένα θειωμένο σύμπλοκο αμινοσακχάρου που μοιάζει με τη θειωμένη γαλακτόζη στη σουλφατίδη (Kalra and Kandimalla, 2021). Έτσι, είναι πιθανό η γλυκοπρωτεΐνη spike να συνδέεται επίσης με τη σουλφατίδη, και αυτό θα μπορούσε να προκαλέσει ανοσολογική αντίδραση στο σύμπλοκο spike-γλυκοπρωτεΐνη-σουλφατίδη.
Όπως περιγράφηκε στην προηγούμενη ενότητα, η μειωμένη σύνθεση σουλφατίδης στο ήπαρ λόγω καταστολής του IRF9 θα οδηγήσει σε συστηματική ανεπάρκεια σουλφατίδης με την πάροδο του χρόνου. Η ανεπάρκεια σουλφατίδης μπορεί να έχει σημαντικές επιπτώσεις στον εγκέφαλο και το νευρικό σύστημα. Το είκοσι τοις εκατό των γαλακτολιπιδίων που βρίσκονται στο περίβλημα της μυελίνης είναι σουλφατίδια. Η σουλφατίδη είναι ένα σημαντικό συστατικό του νευρικού συστήματος, που βρίσκεται σε ιδιαίτερα υψηλές συγκεντρώσεις στο περίβλημα της μυελίνης τόσο στο περιφερικό όσο και στο κεντρικό νευρικό σύστημα.
Η ανεπάρκεια σουλφατιδίων μπορεί να οδηγήσει σε μυϊκή αδυναμία, τρόμο και αταξία (Honke, 2013), τα οποία είναι κοινά συμπτώματα του GBS. Η χρόνια νευροφλεγμονή με τη μεσολάβηση της μικρογλοίας και των αστροκυττάρων στον εγκέφαλο οδηγεί σε δραματικές απώλειες της σουλφατίδης του εγκεφάλου και οι ελλείψεις σουλφατίδης στον εγκέφαλο αποτελούν κύριο χαρακτηριστικό της νόσου του Alzheimer (Qiu et al., 2021).
Τα ποντίκια με ελάττωμα στην ικανότητα σύνθεσης σουλφατίδης από κεραμίδιο παρουσιάζουν μειωμένη ικανότητα διατήρησης της υγείας των αξόνων καθώς γερνούν. Με την πάροδο του χρόνου, αναπτύσσουν πλεονάζοντα, μη συμπιεσμένα και εκφυλισμένα περιβλήματα μυελίνης, καθώς και επιδείνωση της δομής στους κόμβους του Ranvier στους άξονες, προκαλώντας την απώλεια μιας λειτουργικά ικανής αξογλοιακής σύνδεσης (Marcus et al., 2006).
Η αγγειοτενσίνη II (Ang II), εκτός από τις βαθιές επιδράσεις της στην καρδιαγγειακή νόσο, παίζει επίσης ρόλο στη φλεγμονή στον εγκέφαλο που οδηγεί σε νευροεκφυλιστικές νόσους (Lanz. et al., 2010). Η γλυκοπρωτεΐνη αιχμής SARS-CoV-2 περιέχει μια μοναδική θέση διάσπασης φουρίνης που δεν απαντάται στον SARS-CoV, η οποία επιτρέπει στο εξωκυτταρικό ένζυμο φουρίνη να αποσπάσει το τμήμα S1 της γλυκοπρωτεΐνης αιχμής και να την απελευθερώσει στην κυκλοφορία (Letarov et al., 2021). Έχει αποδειχθεί ότι η S1 μπορεί να διασχίσει τον αιματοεγκεφαλικό φραγμό σε ποντίκια (Rhea et al., 2021). Η S1 περιέχει την περιοχή πρόσδεσης υποδοχέα που προσδένεται στους υποδοχείς ACE2, απενεργοποιώντας τους. Όταν μειώνεται η σηματοδότηση των υποδοχέων ACE2, αυξάνεται η σύνθεση της Ang II.
Οι νευρώνες στον εγκέφαλο διαθέτουν υποδοχείς ACE2 οι οποίοι θα ήταν ευαίσθητοι στη διακοπή από το S1 που απελευθερώνεται από εξωσώματα που περιέχουν spike-γλυκοπρωτεΐνες ή από κύτταρα που παράγουν spike-γλυκοπρωτεΐνες και είχαν προσλάβει τα νανοσωματίδια στα εμβόλια. Η Ang II ενισχύει τη μεσολάβηση του TLR4 στη σηματοδότηση στη μικρογλοία, προκαλώντας μικρογλοιακή ενεργοποίηση και αυξάνοντας την παραγωγή αντιδραστικών ειδών οξυγόνου που οδηγούν σε ιστική βλάβη, εντός του παρακοιλιακού πυρήνα στον εγκέφαλο (Rodriguez-Perez et al., 2015).
Τα αυξημένα επίπεδα της Ang II αποτελούν αιτιολογικό παράγοντα νευροεκφυλισμού του οπτικού νεύρου, προκαλώντας οπτική νευρίτιδα, η οποία μπορεί να οδηγήσει σε σοβαρή μη αναστρέψιμη απώλεια όρασης (Guo et al., 2017). Πολλές αναφορές περιπτώσεων έχουν περιγράψει περιπτώσεις οπτικής νευροπάθειας που εμφανίστηκαν λίγο μετά τον εμβολιασμό με mRNA για τη COVID-19 (Maleki, 2021 – Barone et al., 2021). Άλλες εξουθενωτικές νευρολογικές παθήσεις εμφανίζονται επίσης λίγο μετά τον εμβολιασμό, όπου υπάρχει υποψία αιτιώδους σχέσης.
Μια μελέτη περίπτωσης με έδρα την Ευρώπη που παρακολουθούσε νευρολογικά συμπτώματα μετά τον εμβολιασμό COVID-19 εντόπισε 21 περιπτώσεις που εμφανίστηκαν σε διάμεση διάρκεια 11 ημερών μετά τον εμβολιασμό. Τα περιστατικά είχαν ποικίλες διαγνώσεις, συμπεριλαμβανομένης της θρόμβωσης του εγκεφαλικού φλεβικού κόλπου, απομυελινωτικών νόσων του νευρικού συστήματος, φλεγμονωδών περιφερικών νευροπαθειών, μυοσίτιδας, μυασθένειας, μεταιχμιακής εγκεφαλίτιδας και γιγαντοκυτταρικής αρτηρίτιδας (Kaulen et al., 2021).
Οι Khayat-Khoei και συν. (2021) περιγράφουν μια σειρά περιπτώσεων 7 ασθενών, ηλικίας από 24 έως 64 ετών, που εμφάνισαν απομυελινωτική νόσο εντός 21 ημερών από τον πρώτο ή τον δεύτερο εμβολιασμό με mRNA. Τέσσερις είχαν προηγούμενο ιστορικό (ελεγχόμενης) σκλήρυνσης κατά πλάκας, ενώ τρεις ήταν προηγουμένως υγιείς.
Η απώλεια ακοής και οι εμβοές είναι επίσης γνωστές παρενέργειες της COVID-19. Μια μελέτη περίπτωσης περιελάμβανε μια σειρά δέκα ασθενών με COVID-19 οι οποίοι υπέφεραν από οπτικοακουστικά συμπτώματα, όπως απώλεια ακοής, αιθουσαία δυσλειτουργία και εμβοές (Jeong et al., 2021). Οι συγγραφείς απέδειξαν ότι ο ανθρώπινος ιστός του εσωτερικού αυτιού εκκρίνει ACE2, φουρίνη και τη διαμεμβρανική πρωτεάση σερίνη 2 (TMPRSS2), η οποία διευκολύνει την είσοδο του ιού. Έδειξαν επίσης ότι ο SARS-CoV-2 μπορεί να μολύνει συγκεκριμένους ανθρώπινους τύπους κυττάρων του εσωτερικού αυτιού.
Μια άλλη μελέτη που αξιολογεί τη δυνατότητα του ιού SARS-CoV-2 να μολύνει το αυτί εξέτασε συγκεκριμένα την έκφραση του υποδοχέα ACE2 και των ενζύμων furin και TM-PRSS2 διαφόρων τύπων κυττάρων στο μέσο και το εσωτερικό αυτί ποντικών. Διαπίστωσαν ότι ο ACE2 και η φουρίνη ήταν “διάχυτα παρόντες στην ευσταχιανή σάλπιγγα, στους χώρους του μέσου ωτός και στον κοχλία, γεγονός που υποδηλώνει ότι αυτοί οι ιστοί είναι ευαίσθητοι στη μόλυνση από τον ιό SARS-CoV-2″. (Uranaka et al., 2021). Οι εμβοές σχετίζονται θετικά με την υπέρταση, η οποία προκαλείται από τα αυξημένα επίπεδα Ang II (Rodrigues Figueiredo et al., 2016).
Ο πονοκέφαλος είναι μια πολύ συχνή ανεπιθύμητη ενέργεια στα εμβόλια COVID-19 mRNA, ιδίως για άτομα που είναι ήδη επιρρεπή σε πονοκεφάλους. Σε μια μελέτη που βασίστηκε σε ερωτηματολόγιο με 171 συμμετέχοντες, διαπιστώθηκε ότι η συχνότητα εμφάνισης πονοκεφάλων ήταν 20,5 % μετά το πρώτο εμβόλιο και αυξήθηκε σε 45,6 % μετά το δεύτερο εμβόλιο (Sekiguchi et al., 2021). Μια μελέτη περίπτωσης περιέγραψε μια 37χρονη γυναίκα που υπέφερε από εξουθενωτική κρίση ημικρανίας διάρκειας 11 ημερών μετά το δεύτερο εμβόλιο mRNA της Pfizer/BioNtech (Consoli et al., 2021).
Τα στεροειδή χρησιμοποιούνται συχνά ως συμπληρωματική θεραπεία για τη θεραπεία της ημικρανίας (Huang et al., 2013). Η δεξαμεθαζόνη και άλλα στεροειδή διεγείρουν τους υποδοχείς PPAR-α στο ήπαρ μέσω του στεροειδούς υποδοχέα, αντισταθμίζοντας έτσι τα αποτελέσματα της καταστολής του IRF9 (Lemberger et al., 1994).
Μια θεωρία για την προέλευση της ημικρανίας περιλαμβάνει την τροποποιημένη επεξεργασία των αισθητηριακών εισροών στο στέλεχος του εγκεφάλου, κυρίως των νευρώνων του τριδύμου (Dodick and Silberstein, 2006). Το τρίδυμο νεύρο βρίσκεται σε άμεση γειτνίαση με το πνευμονογαστρικό νεύρο στο στέλεχος του εγκεφάλου, οπότε τα εξωσώματα που μεταφέρουν αιχμηρές γλυκοπρωτεΐνες θα μπορούσαν εύκολα να φτάσουν σε αυτό κατά μήκος της πνευμονογαστρικής οδού.
Η απεικόνιση μαγνητικού συντονισμού αποκάλυψε ότι οι δομικές αλλαγές στο τρίδυμο νεύρο που αντανακλούν ανώμαλη μικροδομή και απομυελίνωση αποτελούν χαρακτηριστικό γνώρισμα των ατόμων που πάσχουν από συχνές ημικρανίες (Mungoven et al., 2020). Ένας πιθανός παράγοντας που συνδέεται είτε με τη μόλυνση SARS-CoV-2 είτε με τον εμβολιασμό με mRNA είναι ένα υπερβολικό επίπεδο Ang II στο εγκεφαλικό στέλεχος λόγω της αναστολής των υποδοχέων ACE2 από την αιχμηρή γλυκοπρωτεΐνη SARS-CoV-2.
Οι αναστολείς του ΜΕΑ και οι ανταγωνιστές των υποδοχέων Ang II έχουν γίνει δημοφιλή φάρμακα για τη θεραπεία των πονοκεφάλων ημικρανίας εκτός επισήμανσης (Tronvik et al., 2003 – Nandha and Singh, 2012). Η κεφαλαλγία ημικρανίας θα μπορούσε επομένως να προκύψει τόσο από τη διαταραχή των υποδοχέων ACE2 από τη γλυκοπρωτεΐνη spike όσο και από την καταστροφή του περιβλήματος μυελίνης που καλύπτει κρίσιμα νεύρα του προσώπου μέσω μιας φλεγμονώδους αντίδρασης των μικρογλοίων και της απώλειας σουλφατίδης. Η πηγή αυτής της γλυκοπρωτεΐνης spike θα μπορούσε να είναι είτε εξωγενής είτε ενδογενής.
13. Παράλυση Bell
Η παράλυση του Bell (Bell’s palsy) είναι μια κοινή κρανιακή νευροπάθεια που προκαλεί μονομερή παράλυση του προσώπου. Ακόμη και στις κλινικές δοκιμές φάσης ΙΙΙ, η παράλυση Bell αναδείχθηκε, με επτά περιπτώσεις να εμφανίζονται στο σκέλος της θεραπείας σε σύγκριση με μία μόνο στην ομάδα του εικονικού φαρμάκου (FDA, 2021a – FDA, 2021b).
Μια μελέτη περίπτωσης που αναφέρθηκε στη βιβλιογραφία αφορούσε έναν 36χρονο άνδρα ο οποίος εμφάνισε αδυναμία στο αριστερό χέρι μία ημέρα μετά τον εμβολιασμό, η οποία εξελίχθηκε σε μούδιασμα και μυρμήγκιασμα στο χέρι και επακόλουθα συμπτώματα παράλυσης Bell κατά τις επόμενες ημέρες. Μια κοινή αιτία της παράλυσης Bell είναι η επανενεργοποίηση της λοίμωξης από τον ιό του απλού έρπητα με επίκεντρο το γεννητικό γάγγλιο (Eviston et al., 2015). Αυτό, με τη σειρά του, μπορεί να προκληθεί από διαταραχή της σηματοδότησης της IFN τύπου Ι.
14. Μυοκαρδίτιδα
Έχει δοθεί μεγάλη προσοχή από τα μέσα ενημέρωσης στο γεγονός ότι τα εμβόλια COVID-19 προκαλούν μυοκαρδίτιδα και περικαρδίτιδα, με αυξημένο κίνδυνο ιδίως για τους άνδρες ηλικίας κάτω των 50 ετών (Simone et al., 2021 – Jain et al., 2021). Η γλυκοπρωτεΐνη SARS-CoV-2 spike έχει αποδειχθεί ότι τραυματίζει τα καρδιακά περικύτταρα, τα οποία υποστηρίζουν τα τριχοειδή αγγεία και τα καρδιομυοκύτταρα (Avolio et al., 2020).
Η μυοκαρδίτιδα σχετίζεται με την ενεργοποίηση των αιμοπεταλίων, οπότε αυτός θα μπορούσε να είναι ένας παράγοντας που παίζει ρόλο στην απόκριση στα εμβόλια (Weikert. et al., 2002). Ωστόσο, ένας άλλος παράγοντας θα μπορούσε να σχετίζεται με τα εξωσώματα που απελευθερώνονται από τα μακροφάγα που έχουν προσλάβει τα νανοσωματίδια mRNA και τα συγκεκριμένα microRNA που βρίσκονται σε αυτά τα εξωσώματα.
Μια μελέτη στην οποία συμμετείχαν ασθενείς που έπασχαν από σοβαρή νόσο COVID-19 εξέτασε συγκεκριμένα την έκφραση των κυκλοφορούντων μικροRNAs σε σύγκριση με ασθενείς που έπασχαν από γρίπη και με υγιείς ανθρώπους ελέγχου. Ένα microRNA που βρέθηκε σταθερά ρυθμιζόμενο σε σχέση με την COVID-19 ήταν το miR-155 και οι συγγραφείς πρότειναν ότι μπορεί να αποτελεί προγνωστικό παράγοντα χρόνιας μυοκαρδιακής βλάβης και φλεγμονής.
Αντίθετα, η λοίμωξη από γρίπη δεν συσχετίστηκε με αυξημένη έκφραση του miR-155. Κατέληξαν στο συμπέρασμα: “Η μελέτη μας εντόπισε σημαντικά τροποποιημένα επίπεδα των miRs [microRNAs] που σχετίζονται με την καρδιά σε ασθενείς με COVID-19, υποδεικνύοντας μια ισχυρή συσχέτιση της COVID-19 με καρδιαγγειακές παθήσεις και αντίστοιχους βιοδείκτες” (Garg et al., 2021).
Μια μελέτη που συνέκρινε 300 ασθενείς με καρδιαγγειακή νόσο με υγιείς μάρτυρες έδειξε στατιστικά σημαντική αύξηση των κυκλοφορούντων επιπέδων του miR-155 στους ασθενείς σε σύγκριση με τους ελέγχους. Επιπλέον, εκείνοι με πιο έντονα στενωμένες αρτηρίες (σύμφωνα με τη βαθμολογία Gensini) είχαν υψηλότερα επίπεδα από εκείνους με ασθενέστερη νόσο (Qiu and Ma, 2018).
Είναι σημαντικό ότι τα εξωσώματα παίζουν ρόλο στη φλεγμονή σε συνδυασμό με την καρδιακή νόσο. Κατά τη διάρκεια του εμφράγματος του μυοκαρδίου, ο miR-155 ρυθμίζεται απότομα στα μακροφάγα του καρδιακού μυός και απελευθερώνεται στο εξωκυττάριο περιβάλλον εντός των εξωσωμάτων.
Αυτά τα εξωσώματα παραδίδονται στους ινοβλάστες και ο miR-155 ρυθμίζει προς τα κάτω πρωτεΐνες στους ινοβλάστες που προστατεύουν από τη φλεγμονή και προάγουν τον πολλαπλασιασμό των ινοβλαστών. Η προκύπτουσα βλάβη οδηγεί σε καρδιακή ρήξη (Wang et al., 2017b).
Έχουμε ήδη συζητήσει πώς το τμήμα S1 της γλυκοπρωτεΐνης ακίδας SARS-CoV-2 μπορεί να διασπαστεί από τη φουρίνη και να απελευθερωθεί στην κυκλοφορία. Προσδένεται στους υποδοχείς ACE2 μέσω της περιοχής πρόσδεσης υποδοχέα (RBD) και αυτό αναστέλλει τη λειτουργία τους. Επειδή ο ACE2 αποικοδομεί την Ang II, η απενεργοποίηση του ACE2 οδηγεί άμεσα σε υπερέκφραση της Ang II, ενισχύοντας περαιτέρω τον κίνδυνο καρδιαγγειακής νόσου.
Η αγγειοσύσπαση που προκαλείται από την AngII είναι ένας ανεξάρτητος μηχανισμός πρόκλησης μόνιμης μυοκαρδιακής βλάβης ακόμη και όταν δεν υπάρχει στεφανιαία απόφραξη. Επαναλαμβανόμενα επεισόδια αιφνίδιας συστολής μιας καρδιακής αρτηρίας λόγω Ang II μπορεί τελικά να οδηγήσουν σε καρδιακή ανεπάρκεια ή αιφνίδιο θάνατο (Gavras and Gavras, 2002). Έχουν περιγραφεί θανατηφόρες περιπτώσεις εμβολιασμού κατά της COVID-19 (Choi et al., 2021 – Verma et al., 2021).
Η καταστολή του ACE2 είχε ήδη παρατηρηθεί σε μελέτες για τον αρχικό ιό SARS-CoV. Μια μελέτη αυτοψίας σε ασθενείς που υπέκυψαν στον ιό SARS-CoV αποκάλυψε έναν σημαντικό ρόλο της αναστολής του ACE2 στην προώθηση της καρδιακής βλάβης. Το RNA του ιού SARS-CoV ανιχνεύθηκε στο 35% των 20 αυτοψιών ανθρώπινων καρδιακών δειγμάτων που ελήφθησαν από ασθενείς που πέθαναν.
Υπήρξε αξιοσημείωτη αύξηση της διήθησης των μακροφάγων που σχετίζεται με βλάβη του μυοκαρδίου στους ασθενείς των οποίων οι καρδιές είχαν μολυνθεί με SARS-CoV. Είναι σημαντικό ότι η παρουσία του SARS-CoV στην καρδιά συσχετίστηκε με σημαντική μείωση της πρωτεϊνικής έκφρασης του ACE2 (Oudit et al., 2009).
15. Διαπιστώσεις σχετικά με το Σύστημα Αναφοράς Ανεπιθύμητων Ενεργειών Εμβολίου (VAERS)
Το Σύστημα Αναφοράς Ανεπιθύμητων Ενεργειών Εμβολίων (VAERS) της Υπηρεσίας Τροφίμων και Φαρμάκων είναι μια ατελής αλλά πολύτιμη πηγή για τον εντοπισμό πιθανών ανεπιθύμητων ενεργειών των εμβολίων.
Το VAERS, που δημιουργήθηκε μέσω της συνεργασίας μεταξύ του CDC και του FDA, είναι “ένα εθνικό σύστημα έγκαιρης προειδοποίησης για τον εντοπισμό πιθανών προβλημάτων ασφάλειας σε εμβόλια που έχουν λάβει άδεια κυκλοφορίας στις ΗΠΑ”.
Σύμφωνα με το CDC είναι “ιδιαίτερα χρήσιμο για τον εντοπισμό ασυνήθιστων ή απροσδόκητων προτύπων αναφοράς ανεπιθύμητων συμβάντων που μπορεί να υποδεικνύουν πιθανό πρόβλημα ασφάλειας με ένα εμβόλιο”. (https://vaers.hhs.gov/about.html)
Ακόμη και το CDC αναγνωρίζει ότι τα ανεπιθύμητα συμβάντα που αναφέρονται στο VAERS αντιπροσωπεύουν “μόνο ένα μικρό κλάσμα των πραγματικών ανεπιθύμητων συμβάντων” (Vaers Home, 2021). Μια ευρέως αναφερόμενη έκθεση σημειώνει ότι λιγότερο από το 1% όλων των ανεπιθύμητων συμβάντων που σχετίζονται με τα εμβόλια αναφέρονται στο VAERS (Lazarus et al., 2010). Αυτός ο ισχυρισμός, ωστόσο, δεν έχει καμία παραπομπή, οπότε η βάση του ισχυρισμού δεν είναι σαφής.
Ο Rose (2021) δημοσίευσε μια πολύ πιο εξελιγμένη ανάλυση των δεδομένων VAERS για να προσφέρει μια εκτίμηση της υποδήλωσης κατά 31 φορές (Rose, 2021). Αν και είναι αδύνατο να προσδιοριστεί με ακρίβεια η υποδήλωση, τα διαθέσιμα στοιχεία δείχνουν ότι η υποδήλωση περιγράφει πολύ έντονα τα δεδομένα VAERS. Οι πληροφορίες που παρουσιάζονται κατωτέρω θα πρέπει να κατανοηθούν υπό αυτό το πρίσμα.
Κατά την έρευνα στο VAERS για “σήματα” που θα μπορούσαν να υποδηλώνουν ανεπιθύμητες ενέργειες (ΑΕ) σε εμβολιασμούς mRNA, αναγνωρίζουμε ότι καμία αναφορά στο VAERS δεν τεκμηριώνει αιτιώδη σχέση με τον εμβολιασμό. Ωστόσο, η πιθανότητα αιτιώδους σχέσης ενισχύεται τόσο από τις αιτιώδεις οδούς που περιγράψαμε στην παρούσα εργασία όσο και από την ισχυρή χρονική συσχέτιση μεταξύ των ενέσεων και των αναφερόμενων ΑΕ. Σχεδόν το 60% όλων των σχετιζόμενων με την έγχυση mRNA -ΑΕ συνέβησαν εντός 48 ωρών από την έγχυση (https://medalerts.org/vaersdb/findfield.php?TABLE=ON&GROUP1=ONS&EVENTS=ON&VAX=COVID19&VAXTYPES=COVID-19&STATE=NOTFR).
Θα πρέπει να σημειωθούν δύο σημαντικές επιφυλάξεις σχετικά με την ανάλυση των δεδομένων VAERS. Η πρώτη είναι ότι, εκτός από τους επαγγελματίες του τομέα της υγειονομικής περίθαλψης που υποβάλλουν αναφορές, το VAERS είναι ανοικτό και για δημόσιες αναφορές. Οι πολίτες ενδέχεται να μην διαθέτουν τις απαραίτητες δεξιότητες για να αξιολογήσουν κατάλληλα ένα σύμπτωμα ώστε να καθορίσουν αν αξίζει να καταχωρηθεί στο VAERS. Μια δεύτερη προειδοποίηση είναι ότι η πρόσβαση του κοινού επιτρέπει επίσης την πιθανότητα σε ακτιβιστές κατά του εμβολιασμού να συμπληρώσουν το VAERS με ψευδείς αναφορές για να υπερβάλουν στην εμφάνιση του κινδύνου ΑΕ.
Μια ενδιάμεση ανάλυση των θανάτων που αναφέρθηκε προηγουμένως διαπίστωσε ότι οι υπάλληλοι των υπηρεσιών υγείας ήταν ο αναφέρων στο VAERS στο 67% των αναφορών που αναλύθηκαν (Nandha and Singh, 2012), γεγονός που υποδηλώνει ότι ένα μεγάλο μέρος των αναφορών VAERS υποβάλλεται από επαγγελματίες του ιατρικού τομέα και όχι από τους πολίτες. Το εύρημα αυτό διαψεύδει επίσης την άποψη ότι οι ακτιβιστές κατά του εμβολιασμού υποβάλλουν υπερβολικό αριθμό πρωτοφανών αναφορών για τραυματισμό από εμβόλια.
Όλα τα δεδομένα που αναφέρονται σε αυτό το τμήμα ελήφθησαν από την ηλεκτρονική πηγή http://wonder.cdc.gov/vaers.html. Κατά τη διάρκεια της 31ετούς ιστορίας του VAERS, έως τις 3 Φεβρουαρίου 2022, αναφέρθηκαν συνολικά 10.321 θάνατοι ως “σύμπτωμα” σε σχέση με οποιοδήποτε εμβόλιο και 8.241 (80%) από αυτούς τους θανάτους συνδέθηκαν με τα εμβόλια COVID-19. Είναι σημαντικό ότι μόνο στο 14% των θανάτων που αναφέρθηκαν στην VAERS για τα COVID-19 μέχρι τον Ιούνιο του 2021 μπορούσε να αποκλειστεί ο εμβολιασμός ως αιτία (McLachlan et al., 2021). Αυτό υποδηλώνει έντονα ότι αυτά τα εμβόλια χωρίς προηγούμενο παρουσιάζουν ασυνήθιστους μηχανισμούς τοξικότητας που υπερβαίνουν κατά πολύ αυτό που παρατηρείται με τα πιο παραδοσιακά εμβόλια.
Αποφασίσαμε ότι ένας λογικός τρόπος για να χαρακτηρίσουμε τη σημασία των ανεπιθύμητων συμβάντων που συνδέονται με τα εμβόλια COVID-19 ήταν να επικεντρωθούμε στα συμβάντα που ελήφθησαν το έτος 2021 και να συγκρίνουμε τις μετρήσεις στο πεδίο “SYMPTOM” για τα συμβάντα που σχετίζονται με τα εμβόλια COVID-19 με τις συνολικές μετρήσεις για το ίδιο σύμπτωμα για όλα τα εμβόλια κατά το ίδιο έτος.
Συνολικά, αναφέρθηκαν 737.689 συμβάντα στο VAERS για τα εμβόλια COVID-19 το 2021, που αντιπροσωπεύουν ένα σοκαριστικό 93% των συνολικών περιπτώσεων που αναφέρθηκαν για όλα τα εμβόλια το ίδιο έτος. Ενώ αναγνωρίζουμε ότι ορισμένα από τα εμβόλια COVID-19 βασίζονται στην τεχνολογία φορέων DNA και όχι στην τεχνολογία mRNA, αυτή η κατηγορία (δηλαδή το εμβόλιο Johnson & Johnson) αντιπροσωπεύει λιγότερο από το 9% των αναφορών COVID-19 και το προφίλ αντίδρασης του είναι σίγουρα πολύ παρεμφερές με εκείνο των εμβολίων mRNA παρά με εκείνο όλων των άλλων εμβολίων.
Ο συνολικός αριθμός των αναφορών ανεπιθύμητων ενεργειών για τις ενέσεις COVID-19 είναι πολύ μεγαλύτερος από τον αθροιστικό αριθμό των ετήσιων αναφορών ανεπιθύμητων ενεργειών εμβολίων συνολικά για όλα τα προηγούμενα έτη, όπως φαίνεται από τον Rose (2021). Το εμβόλιο κατά της γρίπης είναι ένα καλό μέτρο σύγκρισης. Δεδομένου ότι το πρωτόκολλο για τα εμβόλια mRNA απαιτεί δύο δόσεις και ότι πολλοί πείστηκαν να λάβουν και μια αναμνηστική ένεση, είναι σαφές ότι ο καθαρός αριθμός των εμβολίων COVID-19 που χορηγήθηκαν είναι μεγάλος σε σύγκριση με άλλα εμβόλια.
Μπορούμε πράγματι να εκτιμήσουμε ποιο ποσοστό των ανεπιθύμητων ενεργειών το 2021 αναμένεται να σχετίζεται με τα εμβόλια COVID-19, εάν η πιθανότητα μιας ανεπιθύμητης ενέργειας ήταν παρόμοια με εκείνη του εμβολίου της γρίπης. Το CDC μας λέει ότι το 52% του πληθυσμού των ΗΠΑ έλαβε εμβόλιο κατά της γρίπης το 2021. Ο δικτυακός τόπος USAFacts παρέχει ποσοστά του πληθυσμού των ΗΠΑ που έλαβαν μία, δύο ή τρεις δόσεις των εμβολίων COVID-19 σε συνάρτηση με το χρόνο (βλ.: https://usafacts.org/visualizations/covid-vaccine-tracker-states/). Οι αριθμοί που αναφέρουν για τις 30 Δεκεμβρίου 2021 είναι 73% με μία δόση, 62% πλήρως εμβολιασμένοι και 21% με “ενίσχυση”. Αυτό ισοδυναμεί με 156% του πληθυσμού ως συνολικό αριθμό εμβολίων COVID-19 που έχουν χορηγηθεί. Αυτό είναι ακριβώς τρεις φορές περισσότερα εμβόλια COVID από τα εμβόλια γρίπης.
Από το VAERS, μπορεί κανείς εύκολα να λάβει τον συνολικό αριθμό ανεπιθύμητων ενεργειών που σχετίζονται με τα εμβόλια COVID-19, τον συνολικό αριθμό που σχετίζονται με τα εμβόλια γρίπης και τον συνολικό αριθμό που σχετίζονται με όλα τα εμβόλια, για τα δεδομένα VAERS των ΗΠΑ με περιορισμούς από το 2021. Αυτά προκύπτουν ως εξής: COVID-19: 737.587, FLU: 9.124, και ALL: 792,935.
Κατ’ αρχάς, μπορούμε να παρατηρήσουμε ότι το 93% όλων των συμβάντων που αναφέρθηκαν συνδέθηκαν με τα εμβόλια COVID-19. Εάν αφαιρέσουμε τις αναφορές για το COVID-19 και τις αντικαταστήσουμε με τις τριπλάσιες αναφορές για τη γρίπη (δεδομένου ότι τα εμβόλια COVID-19 χορηγήθηκαν τρεις φορές πιο συχνά), διαπιστώνουμε ότι τα προϊόντα κατά της COVID-19 θα έπρεπε να αντιπροσωπεύει το 32,6% όλων των συμβάντων, το οποίο μπορεί να συγκριθεί με το πραγματικό αποτέλεσμα, το οποίο είναι 93%.
Μπορούμε επίσης να συμπεράνουμε ότι κάθε συμβάν που εμφανίζεται περισσότερο από 93% τόσο συχνά για τα εμβόλια COVID-19 όσο και για όλα τα άλλα εμβόλια είναι ιδιαίτερα σημαντικό ως πιθανή τοξική επίδραση αυτών των εμβολίων. Τέλος, διαπιστώνουμε ότι υπάρχουν 27 φορές περισσότερες αναφορές για τα εμβόλια COVID-19 απ’ ό,τι θα αναμενόταν αν οι ανεπιθύμητες ενέργειές του ήταν συγκρίσιμες με εκείνες από το εμβόλιο της γρίπης.
15.1. Δεδομένα VAERS ενδεικτικά νευρικής βλάβης και εμπλοκής του πνευμονογαστρικού νεύρου
Ο Πίνακας 1 απαριθμεί ορισμένα συμπτώματα στο VAERS που μπορεί να σχετίζονται με φλεγμονή ή βλάβη διαφόρων σημαντικών νεύρων του σώματος, ιδίως εκείνων που βρίσκονται στο κεφάλι. Είναι εντυπωσιακό ότι τα εμβόλια COVID-19 αντιπροσώπευαν από 96 έως 98% των αναφορών το έτος 2021 που αφορούσαν καθεμία από αυτές τις εξουθενωτικές καταστάσεις. Υπήρχαν σχεδόν 100.000 περιπτώσεις ναυτίας ή εμέτου, που αποτελούν συνηθισμένα συμπτώματα διέγερσης ή βλάβης του πνευμονογαστρικού νεύρου (Babic and Browning, 2014).
Οι 14.701 περιπτώσεις συγκοπής που συνδέονται με τα εμβόλια COVID-19 αντιπροσώπευαν το 96,3% όλων των περιπτώσεων συγκοπής, ένα καθιερωμένο χαρακτηριστικό της δυσλειτουργίας του πνευμονογαστρικού νεύρου (Fenton et al., 2000). Υπήρχαν 3.657 περιπτώσεις ανοσμίας (απώλεια όσφρησης), γεγονός που αποδεικνύει σαφώς ότι η γλυκοπρωτεΐνη SARS-CoV-2 spike από την ένεση στο χέρι κατέληξε στο οσφρητικό νεύρο. Η δύσπνοια (δύσπνοια) σχετίζεται με την εξασθένιση του πνευμονογαστρικού νεύρου στους πνεύμονες και υπήρξαν 39.551 περιπτώσεις δύσπνοιας που συνδέονται με τα εμβόλια COVID-19 το 2021.
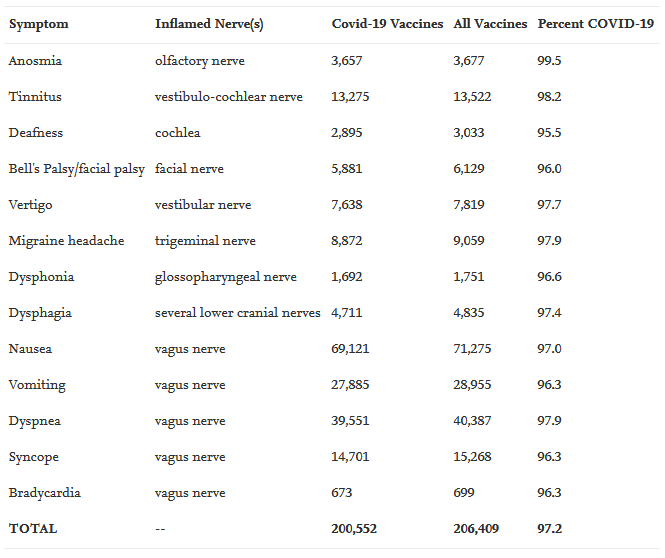 Πίνακας 1. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες ανεπιθύμητες ενέργειες που θα μπορούσαν να προκληθούν από φλεγμονή σε συναφή κύρια νεύρα, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
Πίνακας 1. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες ανεπιθύμητες ενέργειες που θα μπορούσαν να προκληθούν από φλεγμονή σε συναφή κύρια νεύρα, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.Συνολικά, οι εν λόγω καταγραφές ανέρχονται σε πάνω από 200.000 περιπτώσεις, αντιπροσωπεύοντας το 97,2% του συνόλου των καταχωρίσεων που σχετίζονται με οποιοδήποτε εμβόλιο το 2021.
Πρόκειται επίσης για ένα σημαντικό 27,2% του συνόλου των συμβάντων που αναφέρονται για το 2021 σε σχέση με τα εμβόλια COVID-19.
15.2. Δεδομένα VAERS σχετικά με την καρδιά και το ήπαρ
Στο παρόν έγγραφο, έχουμε εντοπίσει τόσο την καρδιά όσο και το ήπαρ ως όργανα που αναμένεται να επηρεαστούν από τα εμβόλια mRNA. Η βάση δεδομένων VAERS δείχνει ένα ισχυρό σήμα και για τα δύο όργανα.
Ο Πίνακας 2 παρουσιάζει τα στατιστικά στοιχεία για το 2021 σχετικά με σημαντικές διαταραχές της καρδιάς, συμπεριλαμβανομένης της μυοκαρδίτιδας, της ανακοπής (καρδιακή, καρδιοαναπνευστική και φλεβοκομβική ανακοπή), της αρρυθμίας (συμπεριλαμβανομένης της υπερκοιλιακής, κομβικής, φλεβοκομβικής, ταχυαρρυθμίας και κοιλιακής αρρυθμίας), του εμφράγματος του μυοκαρδίου (συμπεριλαμβανομένου του οξέος και του σιωπηρού) και της καρδιακής ανεπάρκειας (συμπεριλαμβανομένης της οξείας, της χρόνιας και της συμφορητικής). Συνολικά, υπήρξαν συνολικά 8.090 συμβάντα COVID-19 που σχετίζονται με αυτές τις καρδιακές παθήσεις, αντιπροσωπεύοντας σχεδόν το 98% όλων των συμβάντων για όλα τα εμβόλια για αυτά τα συμπτώματα το 2021.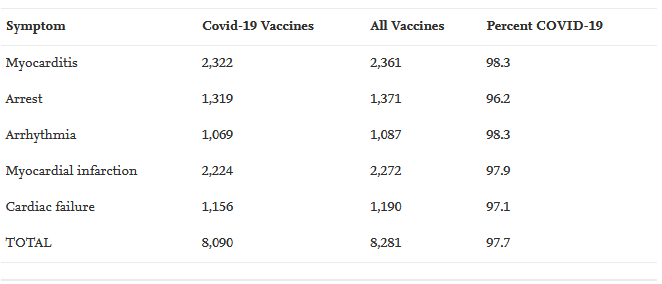 Πίνακας 2. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές της καρδιάς, με συνολική καταγραφή για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
Πίνακας 2. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές της καρδιάς, με συνολική καταγραφή για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
 Πίνακας 2. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές της καρδιάς, με συνολική καταγραφή για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
Πίνακας 2. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές της καρδιάς, με συνολική καταγραφή για τα εμβόλια COVID-19 και για όλα τα εμβόλια.Είναι δύσκολο να βρεθούν όλα τα συμπτώματα που σχετίζονται με ηπατική βλάβη στο VAERS, αλλά επιλέξαμε έναν αριθμό που είχε αρκετά υψηλά ποσοστά ώστε να παρουσιάζει ενδιαφέρον και που αντιπροσωπεύει σαφώς σοβαρά ηπατικά προβλήματα. Συνολικά υπήρχαν 731 συμβάντα σε αυτές τις κατηγορίες για τα εμβόλια COVID-19, όπως φαίνεται στον πίνακα 3, που αντιπροσωπεύουν πάνω από το 97% όλων των περιπτώσεων που συνδέουν αυτές τις καταστάσεις με οποιοδήποτε εμβόλιο το 2021.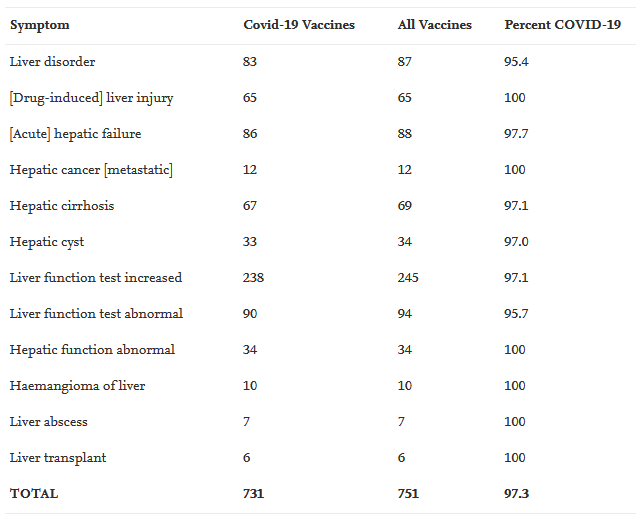

Πίνακας 3. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορους δείκτες ηπατικής νόσου, με συνολική καταγραφή για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
15.3. Δεδομένα VAERS σχετικά με θρομβώσεις
Υπήρχαν 78 μοναδικά συμπτώματα στο VAERS που αφορούσαν θρόμβωση, προσδιορίζοντας διαφορετικές αρτηρίες και φλέβες. Ο Πίνακας 4 παρουσιάζει εννέα συμπτώματα με τα υψηλότερα ποσοστά, συνολικά 7.356 συμβάντα.
Διερευνήσαμε το χρονικό διάστημα για τα τρία κυρίαρχα (θρόμβωση, εν τω βάθει φλεβοθρόμβωση, και πνευμονική θρόμβωση) και διαπιστώσαμε ότι όλα αυτά έχουν μια απότομη αιχμή στο εύρος 15-30 ημερών για το διάστημα έναρξης (χρόνος μετά τον εμβολιασμό). Αυτό συμπίπτει με μια απότομη αιχμή στην πνευμονική εμβολή, μια απειλητική για τη ζωή κατάσταση, επίσης στο χρονικό διάστημα 15-30 ημερών.
Συνολικά, για αυτά τα εννέα θρομβωτικά συμπτώματα, μια τυχαία δειγματοληψία από το έτος 2021 θα προέκυπτε εμβόλιο COVID σε αντίθεση με οποιοδήποτε άλλο εμβόλιο στο 98,7% των περιπτώσεων. Η πνευμονική εμβολή, μια απειλητική για τη ζωή κατάσταση που μπορεί να προκληθεί από θρόμβο αίματος που ταξιδεύει στους πνεύμονες, έχει ελαφρώς υψηλότερη πιθανότητα 98,8%, με 3.100 περιπτώσεις που αναφέρονται για το προϊόν COVID-19.
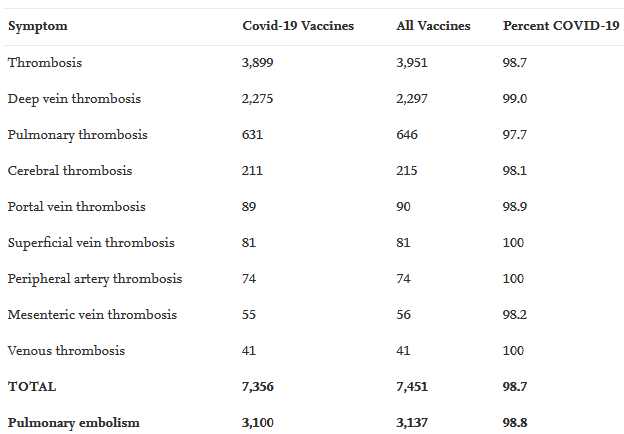 Πίνακας 4. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένος στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορους ειδικούς τύπους θρόμβωσης, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια. Παρουσιάζεται επίσης η πνευμονική εμβολή, ένα εξαιρετικά συναφές σύμπτωμα.
Πίνακας 4. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένος στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορους ειδικούς τύπους θρόμβωσης, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια. Παρουσιάζεται επίσης η πνευμονική εμβολή, ένα εξαιρετικά συναφές σύμπτωμα.15.4. Δεδομένα VAERS σχετικά με νευροεκφυλιστικές νόσους
Στον πίνακα 5 παρατίθενται τα αποτελέσματα για διάφορες καταστάσεις που συνδέονται με νευροεκφυλιστικές νόσους. Η μειωμένη κινητικότητα μπορεί να προκληθεί από τη νόσο του Πάρκινσον, και καταγράφηκαν 8.975 περιστατικά για τα εμβόλια 2021 και COVID-19. Η νόσος του Αλτσχάιμερ και η νόσος του Πάρκινσον είναι ασθένειες που συνήθως χρειάζονται δεκαετίες για να αναπτυχθούν, και κανονικά θα υπέθετε κανείς ότι ένα εμβόλιο δεν έχει καμία σχέση με αυτό.
Ενώ οι αριθμοί είναι μικροί, τα περισσότερα από τα κρούσματα στο VAERS συνδέθηκαν με τα εμβόλια COVID-19. Η ανοσμία, που περιλαμβάνεται επίσης στον πίνακα για το πνευμονογαστρικό νεύρο, είναι ιδιαίτερα ενδιαφέρουσα, επειδή είναι ένα γνωστό πρώιμο σημάδι της νόσου του Πάρκινσον και είναι επίσης ένα καλά αναγνωρισμένο χαρακτηριστικό της λοίμωξης SARS-CoV-2. Το 99,5% των περιπτώσεων με σύμπτωμα ανοσμία συνδέθηκε με τα εμβόλια COVID-19. Συνολικά, τα συμπτώματα σε αυτόν τον πίνακα συνδέθηκαν με τα εμβόλια COVID-19 σχεδόν στο 95% των περιπτώσεων.
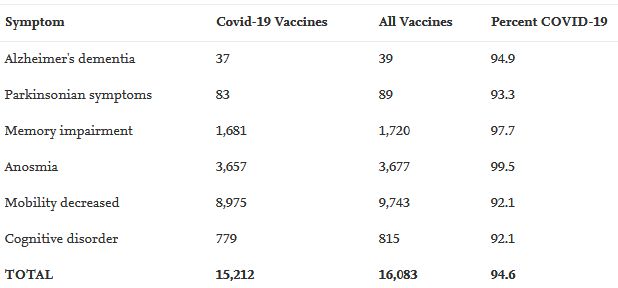 Πίνακας 5. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές που συνδέονται με νευροεκφυλιστικές νόσους, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
Πίνακας 5. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορες διαταραχές που συνδέονται με νευροεκφυλιστικές νόσους, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.15.5. Ίχνη στο VAERS για καρκίνο
Ο καρκίνος είναι μια ασθένεια που γενικά θεωρείται ότι χρειάζεται μήνες ή, γενικότερα, χρόνια για να εξελιχθεί από έναν αρχικό κακοήθη μετασχηματισμό σε ένα κύτταρο μέχρι την ανάπτυξη μιας κλινικά αναγνωρισμένης κατάστασης.
Δεδομένου ότι οι αναφορές VAERS για ανεπιθύμητα συμβάντα συμβαίνουν κυρίως εντός του πρώτου μήνα ή ακόμη και των πρώτων ημερών μετά τον εμβολιασμό (Rose, 2021), φαίνεται πιθανό ότι η επιτάχυνση της εξέλιξης του καρκίνου μετά τα εμβόλια αποτελεί δύσκολο μήνυμα αναγνώρισης. Επιπλέον, οι περισσότεροι άνθρωποι δεν αναμένουν ότι ο καρκίνος θα ήταν ένα ανεπιθύμητο συμβάν που θα μπορούσε να προκληθεί από ένα εμβόλιο, και ως εκ τούτου δεν καταχωρούν μια αναφορά όταν ο καρκίνος αναπτύσσεται λίγο μετά τον εμβολιασμό.
Ωστόσο, όπως έχουμε περιγράψει στο έγγραφό μας, εάν οι εμβολιασμοί με mRNA οδηγούν σε ευρεία δυσλειτουργία του ελέγχου των ογκογονιδίων, της ρύθμισης του κυτταρικού κύκλου και της απόπτωσης, τότε οι αναφορές VAERS θα πρέπει να αντανακλούν μια αύξηση των αναφορών καρκίνου, σε σχέση με τα άλλα εμβόλια, ακόμη και αν οι αριθμοί είναι μικροί. Το πείραμα που καταδεικνύει την εξασθένιση των μηχανισμών επιδιόρθωσης του DNA από την πρωτεΐνη spike του SARS-CoV-2 σε μια in vitro μελέτη παρέχει αδιάσειστα στοιχεία ότι τα εμβόλια θα μπορούσαν να επιταχύνουν το ρυθμό των μεταλλάξεων του DNA, αυξάνοντας τον κίνδυνο καρκίνου (Jiang and Mei, 2021).
Για την ανάλυσή μας σχετικά με τις ενδείξεις αυξημένου κινδύνου καρκίνου στο VAERS, εστιάσαμε σε δύο κάπως διαφορετικές προσεγγίσεις. Η μία, η οποία αντιπροσωπεύεται από τα αποτελέσματα στον Πίνακα 6, ήταν να συγκεντρώσουμε τις μετρήσεις για κάθε όρο που περιείχε λέξεις-κλειδιά που συνδέονται σαφώς με τον καρκίνο, δηλαδή “καρκίνος”, “λέμφωμα”, “λευχαιμία”, “μετάσταση”, “καρκίνωμα” και “νεόπλασμα”.
Συνολικά, βρήκαμε 1.474 καταχωρίσεις που συνέδεαν αυτούς τους όρους με τα εμβόλια COVID-19, που αντιπροσωπεύουν το 96% όλων των καταχωρίσεων για οποιονδήποτε από αυτούς τους όρους για οποιοδήποτε εμβόλιο εκείνης της χρονιάς.
Πίνακας 6. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένος στον πληθυσμό των ΗΠΑ, για το έτος 2021, για διάφορους όρους που σχετίζονται με τον καρκίνο, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
Η συμπληρωματική προσέγγιση ήταν η εύρεση όρων που αφορούσαν τον καρκίνο σε συγκεκριμένα όργανα, δηλαδή, στήθος, προστάτης, ουροδόχος κύστη, παχύ έντερο, εγκέφαλος, πνεύμονες, πάγκρεας και ωοθήκες, όπως φαίνεται στον πίνακα 7. Αν και όλοι οι αριθμοί είναι μικροί, ο μεγαλύτερος με διαφορά ήταν για τον καρκίνο του μαστού (246 περιπτώσεις), με σχεδόν τετραπλάσιες εμφανίσεις από ό,τι για τον καρκίνο του πνεύμονα, τον δεύτερο συχνότερο τύπο.
Όλες οι περιπτώσεις για τον καρκίνο του παγκρέατος, των ωοθηκών και της ουροδόχου κύστης συνδέθηκαν με τα εμβόλια COVID-19, ενώ μηδέν περιπτώσεις για οποιοδήποτε άλλο εμβόλιο. Συνολικά, καταγράψαμε 534 περιπτώσεις καρκίνου συγκεκριμένων οργάνων που συνδέονται με τα εμβόλια COVID-19, αντιπροσωπεύοντας το 97,3% όλων των περιπτώσεων για οποιοδήποτε εμβόλιο το 2021.
Πίνακας 7. Αριθμός συμπτωμάτων που αναφέρθηκαν στο VAERS, περιορισμένα στον πληθυσμό των ΗΠΑ, για το έτος 2021, για καρκίνο συγκεκριμένων οργάνων, με συνολική καταμέτρηση για τα εμβόλια COVID-19 και για όλα τα εμβόλια.
16. Συμπεράσματα
Ο μηχανισμός δημόσιας υγείας στις ΗΠΑ και σε όλο τον κόσμο έχει δώσει ένα κατηγορηματικό μήνυμα σχετικά με την ασφάλεια και την αποτελεσματικότητα των εμβολιασμών με mRNA κατά του SARS-CoV-2. Η αποτελεσματικότητα τίθεται όλο και περισσότερο υπό αμφισβήτηση, όπως φαίνεται σε μια πρόσφατη επιστολή του Günter Kampf (2021b) στο Lancet Regional Health. Ο Kampf παρέθεσε στοιχεία που δείχνουν ότι οι εμβολιασμένοι είναι πλέον εξίσου πιθανό με τους ανεμβολίαστους να μεταδώσουν την ασθένεια.
Κατέληξε στο συμπέρασμα: “Φαίνεται ότι είναι μεγάλη αμέλεια να αγνοηθεί ο εμβολιασμένος πληθυσμός ως πιθανή και σχετική πηγή μετάδοσης όταν αποφασίζονται μέτρα ελέγχου της δημόσιας υγείας”. Επιπλέον, η ανεπάρκεια των δοκιμών φάσης Ι, ΙΙ και ΙΙΙ για την αξιολόγηση των μεσοπρόθεσμων και μακροπρόθεσμων παρενεργειών από τα γενετικά εμβόλια mRNA μπορεί να ήταν παραπλανητική ως προς την κατασταλτική τους επίδραση στην έμφυτη ανοσία των εμβολιαζόμενων.
Στην παρούσα εργασία, εφιστούμε την προσοχή σε τρεις πολύ σημαντικές πτυχές του προφίλ ασφάλειας αυτών των εμβολιασμών. Η πρώτη είναι η εκτενώς τεκμηριωμένη ανατροπή της έμφυτης ανοσίας, κυρίως μέσω της καταστολής της IFN-α και του σχετικού συστήματος σηματοδότησης.
Αυτή η καταστολή θα έχει ένα ευρύ φάσμα συνεπειών, μεταξύ των οποίων περιλαμβάνονται, η επανενεργοποίηση λανθάνουσας ιογενούς λοίμωξης και η μειωμένη ικανότητα αποτελεσματικής καταπολέμησης μελλοντικών λοιμώξεων. Δεύτερον, είναι η απορρύθμιση του συστήματος τόσο για την πρόληψη όσο και για την ανίχνευση των γενετικά καθοδηγούμενων κακοήθων μετασχηματισμών εντός των κυττάρων και η συνακόλουθη δυνατότητα του εμβολιασμού να προάγει αυτούς τους μετασχηματισμούς.
Τρίτον, ο εμβολιασμός με mRNA διαταράσσει ενδεχομένως την ενδοκυτταρική επικοινωνία που διεξάγεται από τα εξωσώματα και ωθεί τα κύτταρα που προσλαμβάνουν mRNA γλυκοπρωτεΐνης spike να παράγουν υψηλά επίπεδα εξωσωμάτων που μεταφέρουν γλυκοπρωτεΐνη spike, με δυνητικά σοβαρές φλεγμονώδεις συνέπειες.
Εάν οποιαδήποτε από αυτές τις δυνατότητες υλοποιηθεί πλήρως, ο αντίκτυπος σε δισεκατομμύρια ανθρώπους σε όλο τον κόσμο θα μπορούσε να είναι τεράστιος και θα μπορούσε να συμβάλει τόσο στη βραχυπρόθεσμη όσο και στη μακροπρόθεσμη επιβάρυνση των ασθενειών που αντιμετωπίζει το σύστημα υγειονομικής περίθαλψης.
Δεδομένης της σημερινής ταχέως αναπτυσσόμενης συνειδητοποίησης των πολλαπλών ρόλων των G4s στη ρύθμιση της μετάφρασης του mRNA και της κάθαρσης μέσω των κοκκίων στρες, η αύξηση των pG4s λόγω του εμπλουτισμού του περιεχομένου GC ως συνέπεια της βελτιστοποίησης των κωδικονίων έχει άγνωστες αλλά πιθανώς εκτεταμένες συνέπειες.
Απαιτείται επειγόντως ειδική αναλυτική αξιολόγηση της ασφάλειας αυτών των κατασκευών στα εμβόλια, συμπεριλαμβανομένης της φασματομετρίας μάζας για τον εντοπισμό κρυπτικής έκφρασης και μελετών ανοσοκατακρήμνισης για την αξιολόγηση της πιθανότητας διαταραχής ή παρεμβολής στις βασικές δραστηριότητες των πρωτεϊνών δέσμευσης RNA και DNA.
Είναι απαραίτητο να διεξαχθούν περαιτέρω μελέτες για να προσδιοριστεί η έκταση των πιθανών παθολογικών συνεπειών που περιγράφονται στην παρούσα εργασία. Δεν είναι πρακτικά δυνατό οι εμβολιασμοί αυτοί να θεωρηθούν μέρος μιας εκστρατείας δημόσιας υγείας χωρίς λεπτομερή ανάλυση των ανθρώπινων επιπτώσεων των πιθανών παράπλευρων βλαβών.
Τα VAERS και άλλα συστήματα παρακολούθησης θα πρέπει να βελτιστοποιηθούν ώστε να ανιχνεύουν σήματα που σχετίζονται με τις συνέπειες του εμβολιασμού με mRNA στην υγεία που περιγράψαμε. Πιστεύουμε ότι το αναβαθμισμένο σύστημα παρακολούθησης VAERS που περιγράφεται στη μελέτη Harvard Pilgrim Health Care, Inc. αλλά δυστυχώς δεν υποστηρίζεται από το CDC, θα ήταν μια πολύτιμη αρχή από αυτή την άποψη (Lazarus et al., 2010).
Εν τέλει, δισεκατομμύρια ζωές κινδυνεύουν, δεδομένου του μεγάλου αριθμού ατόμων που έκαναν ένεση με τα εμβόλια SARS-CoV-2 mRNA και του ευρέος φάσματος ανεπιθύμητων ενεργειών που περιγράψαμε. Καλούμε τους φορείς δημόσιας υγείας να αποδείξουν, με στοιχεία, γιατί τα ζητήματα που συζητούνται στο παρόν έγγραφο δεν αφορούν τη δημόσια υγεία ή να αναγνωρίσουν ότι αφορούν και να ενεργήσουν αναλόγως. Επιπλέον, ενθαρρύνουμε όλα τα άτομα να λάβουν τις δικές τους αποφάσεις για την υγειονομική περίθαλψη με αυτές τις πληροφορίες ως παράγοντα που συμβάλλει στις αποφάσεις αυτές.
Δήλωση ανταγωνιστικών συμφερόντων
Οι συγγραφείς δηλώνουν ότι δεν έχουν ανταγωνιστικά οικονομικά συμφέροντα ή προσωπικές σχέσεις που θα μπορούσαν να επηρεάσουν την έρευνα που αναφέρεται στην παρούσα μελέτη.

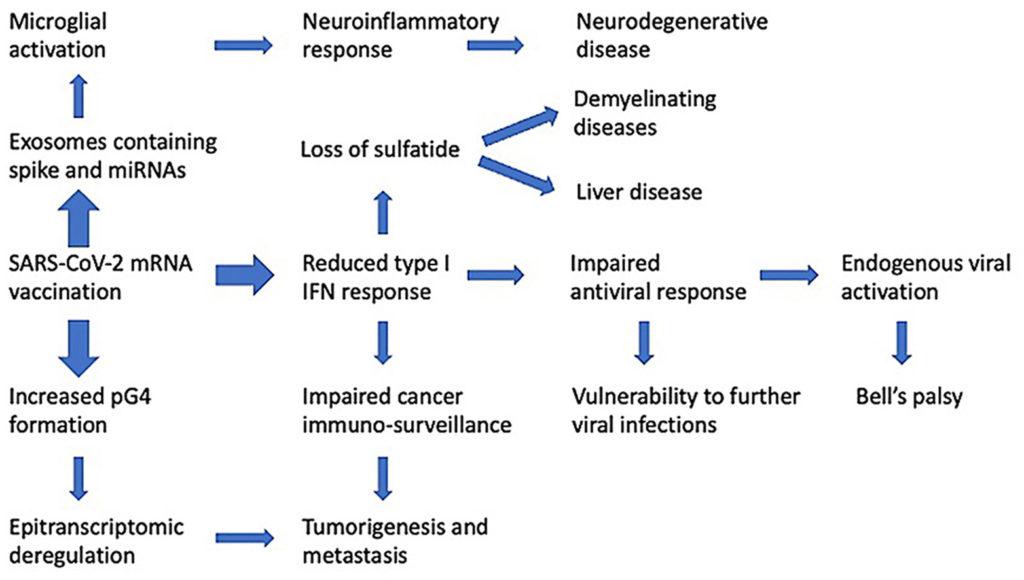
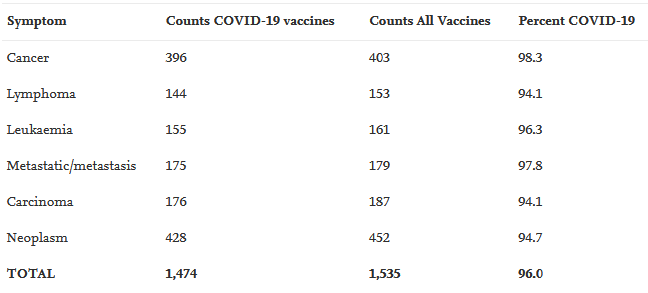
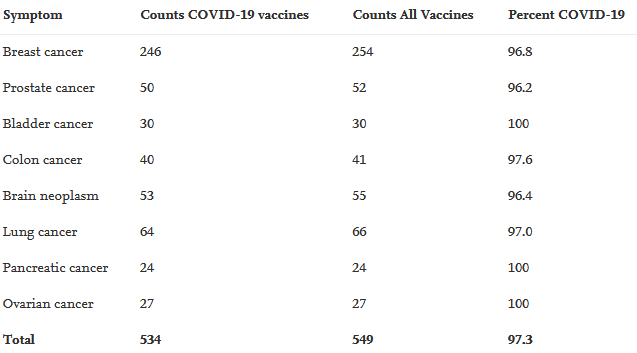




















Ένας εισαγγελέας υπάρχει να τους κλείσει μέσα για έγκλημα κατά της ανθρωπότητας; στην Ελλάδα έχουν αυξηθεί κατά 25% οι θάνατοι από τον Μάρτιο του 2020, γύρω μας ακούμε συνεχώς για "ξαφνικούς" θανάτους! Η Ιεραρχία της Εκκλησίας που άφησε το ποιμαντικό της έργο και έγινε DEALER εμβολίων έχει ακούσει κάτι; για τους Μητροπολίτες που εμβολιαστηκαν και πεθαίνουν έχει μήπως ακούσει κάτι; θα αφυπνίσει επιτέλους τον λαό του Θεού; ΑΝΑΞΙΟΙ εκεί στην Ιεραρχία!!!!
ΑπάντησηΔιαγραφή